
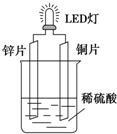
 以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.某实验兴趣小组做完实验后,在读书卡片上记录如下:
以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.某实验兴趣小组做完实验后,在读书卡片上记录如下:| 实验后的记录: ①Zn片发生还原反应,Cu片发生氧化反应 ②H+向负极移动 ③LED发光时,电子流动方向Zn→导线→Cu,再经溶液流回铜片 ④溶液的pH变小 ⑤若有1mol电子流过导线,则产生H2为0.5mol. ⑥装置中存在“化学能→电能→光能”的转换 |
| 序号 | 甲 | 乙 | 丙 |
| 装置 | 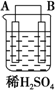 | 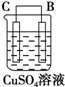 | 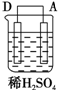 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
分析 (1)锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,发生还原反应,原电池中阳离子向正极移动,阴离子向负极移动,以此解答;
(2)形成原电池能加快反应速率;
(3)当锌片不纯时,在锌片上形成原电池;
(4)把硫酸换成硫酸铜溶液,正极上铜离子得电子生成铜单质;根据正负极的电极反应计算;
(5)甲、乙、丙为原电池装置,甲中A不断溶解,说明A被氧化,为原电池负极,B为正极,乙中C的质量增加,说明C极上析出金属,为原电池正极,则B为负极,丙中A上有气体产生,应为氢气,说明A为正极,则D为负极,原电池反应中负极较活泼,以此解答该题.
解答 解:(1)锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,电极方程式为Zn-2e-═Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e-═H2↑,由此可知若有1mol电子流经导线,则产生0.5mol氢气,电子由负极经外电路流向正极,原电池中阳离子向正极移动,阴离子向负极移动,则正确的有③⑤,
故答案为:③⑤;
(2)Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,能加快锌与硫酸的反应速率,所以其他条件相同情况下,产生气泡的速率比单一锌片快;
故答案为:快;
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,是由于锌片不纯,在锌片上形成原电池导致,
故答案为:锌片不纯,在锌片上形成原电池;
(4)如果把硫酸换成硫酸铜溶液,正极Cu上会有铜单质析出,而变粗,其电极反应为:Cu2++2e-=Cu;则电池总反应为Zn与铜离子的反应,为Cu2++Zn=Zn2++Cu,
已知正极:Cu2++2e-=Cu,负极:Zn-2e-=Zn2+,设电路中转移电子的物质的量为n,则正极质量增加32n,负极质量减少32.5n,所以32.5n+32n=12.9g,解得n=0.2mol,
故答案为:铜极;Cu2++Zn=Zn2++Cu;0.2;
(5)甲、乙、丙为原电池装置,甲中A不断溶解,说明A被氧化,为原电池负极,B为正极,乙中C的质量增加,说明C极上析出金属,为原电池正极,则B为负极,丙中A上有气体产生,应为氢气,说明A为正极,则D为负极,原电池反应中负极较活泼,则金属的活泼性顺序为D>A>B>C,故答案为:D>A>B>C.
点评 本题考查学生原电池的工作原理以及电极反应和电子转移之间的关系知识,注意把握原电池的构成条件、电极方程式的书写等基础知识的积累,题目难度中等.


科目:高中化学 来源: 题型:实验题
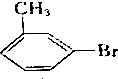 ,写出其同分异构体的结构简式:
,写出其同分异构体的结构简式: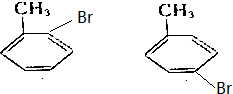 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
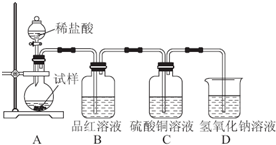
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤中存在苯、二甲苯,工业上可由煤蒸馏获得 | |
| B. | 直馏汽油和裂化汽油中分别加入溴的四氯化碳溶液均能发生化学反应 | |
| C. | 石油的裂化、裂解和煤的干馏、气化都属于化学变化 | |
| D. | 石油裂解是生产乙烯的主要方法,乙烯和聚乙烯均能使溴水发生反应而褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②④ | C. | ①③⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl HCl H2O NaOH | B. | Cl2Na2S HCl CO2 | ||
| C. | HBr CCl4H2O CO2 | D. | Na2O2H2O2H2O O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 -C≡C-CH=CH-CH3,有关其结构说法正确的是( )
-C≡C-CH=CH-CH3,有关其结构说法正确的是( )| A. | 所有碳原子不可能在同一平面上 | B. | 所有碳原子可能在同一条直线上 | ||
| C. | 碳原子同一平面上至少有9个 | D. | 所有原子可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
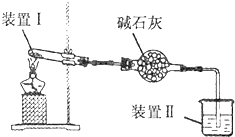 按如图所示装置进行实验,装置中现象II不正确的是( )
按如图所示装置进行实验,装置中现象II不正确的是( )| 选项 | 装置I中试剂 | 装置Ⅱ中试剂 | 装置Ⅱ中现象 |
| A | 浸透了石蜡油的石棉和碎瓷片 | 酸性高锰酸钾溶液 | 紫色溶液褪色 |
| B | 铁粉和用水浸泡的棉团 | 肥皂水 | 肥皂水冒泡 |
| C | 碳酸氢钠 | 澄清石灰水 | 有沉淀生成 |
| D | 硫酸铵 | 酚酞溶液 | 溶液变红 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com