
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为_________________,基态Fe原子的价电子排布图为________________。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是__________,与CO互为等电子体的分子的电子式为_________________。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是_____________,配体中提供孤对电子的原子是___________________________________。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有_______________形成。
a.离子键 b.配位键 c.非极性键 d.б键
(5)NaAlH4晶体的晶胞如图 ,与Na+紧邻且等距的AlH4-有___________个;NaAlH4晶体的密度为_________g·cm-3(用含a的代数式表示)。
,与Na+紧邻且等距的AlH4-有___________个;NaAlH4晶体的密度为_________g·cm-3(用含a的代数式表示)。
【答案】 O>N>C(1分) ![]() 分子晶体
分子晶体 ![]() sp2、sp3 N bd 8
sp2、sp3 N bd 8 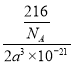 (或“
(或“![]() ”)
”)
【解析】(1)同一周期元素,元素电负性随着原子序数增大而增大,这三种元素第一电离能大小顺序是O>N>C;Fe原子3d、4s能级电子为其价电子,基态Fe原子的价电子排布图为![]() ;(2)熔沸点较低的晶体为分子晶体,Fe(CO)5又名羰基铁,常温下为黄色油状液体,其熔沸点较低,为分子晶体;与CO互为等电子体的分子是氮气分子,电子式为
;(2)熔沸点较低的晶体为分子晶体,Fe(CO)5又名羰基铁,常温下为黄色油状液体,其熔沸点较低,为分子晶体;与CO互为等电子体的分子是氮气分子,电子式为![]() ;(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式为sp3、sp2,该配体中Cu原子提供空轨道、N原子提供孤电子对;(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有Cu原子和N、C原子之间的配位键且也是δ键生成,答案选bd;(5)根据均摊法可知,晶胞中AlH4-数目为1+8×1/8+4×1/2=4,Na+数目为6×1/2+4×1/4=4,则二者配位数为1:1,以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,则与Na+紧邻且等距的AlH4-有8个;晶胞质量为4×54/NAg,晶胞密度为
;(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式为sp3、sp2,该配体中Cu原子提供空轨道、N原子提供孤电子对;(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有Cu原子和N、C原子之间的配位键且也是δ键生成,答案选bd;(5)根据均摊法可知,晶胞中AlH4-数目为1+8×1/8+4×1/2=4,Na+数目为6×1/2+4×1/4=4,则二者配位数为1:1,以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,则与Na+紧邻且等距的AlH4-有8个;晶胞质量为4×54/NAg,晶胞密度为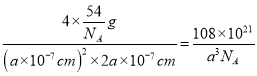 gcm-3。
gcm-3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)在原电池中,通常较活泼的金属做_____极,发生_______反应;
电解池中,与电源正极相连的极是_______极,发生________反应。
(2)下图所示水槽中试管内有一枚铁钉,放置数天后观察:
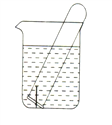
①若试管内液面上升,发生_____腐蚀,正极反应式为________________。
②若试管内液面下降,发生_______腐蚀,正极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等领域。
(1)Ti的基态原子的电子排布式为________。
(2)已知TiC在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原TiO2制取TiC: TiO2+3C![]() TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。
TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。
(3)钛的化合物TiCl4,熔点为-24℃,沸点为136.4℃,常温下是无色液体,可溶于甲苯和氯代烃。
①固态TiCl4属于________晶体,其空间构型为正四面体,则钛原子的杂化方式为__________。
②TiCl4遇水发生剧烈的非氧化还原反应,生成两种酸,反应的化学方程式为_________
③用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的配合物[TiCl(H2O)5]Cl2·H2O.该配合物中含有化学键的类型有_________、__________。
(4)钛的一种氧化物是优良的颜料,该氧化物的晶胞如右图所示:

该氧化物的化学式为________;在晶胞中Ti原子的配位数为_______,若晶胞边长为a nm,NA为阿伏伽德罗常数的数值,列式表示氧化钛晶体的密度:___________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,每种物质都既能被氧化又能被还原的是( )
A.FeCl2、Cl2、CuSO4
B.Cl2、Al、H2
C.H2S、HCl、H2O2
D.F2、K、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是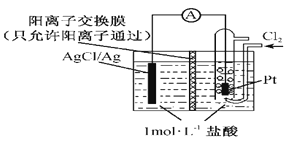
A. 正极反应为AgCl+e-=Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与盐类的水解无关的是( )
A. 明矾净水B. NaCl可用作防腐剂和调味剂
C. 热的纯碱溶液可去除油污D. FeCl3饱和溶液滴入沸水中制备Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlCl3是一种催化剂,某校学习小组用下面装置制备少量AlCl3。已知:AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl;AlCl3在180℃时升华。根据要求完成下列问题:

(1)a仪器的名称为_______;A装置中反应的化学方程式为_______。
(2)试剂b为_______;C装置的作用为_______。
(3)所用d导管较粗的原因是_______;E装置的作用为_______。
(4)F装置的作用为_______。
(5)若上图中的D、E装置改为下面装置,D装置中的现象为_______;用离子方程式表示E中的现象变化_______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com