
�ں����ܱ�������ͨ��X��������Ӧ��2X(g) Y(g)���¶�T1��T2��X�����ʵ���Ũ��C(X)��ʱ��t�仯��������ͼ��ʾ������������ȷ����
Y(g)���¶�T1��T2��X�����ʵ���Ũ��C(X)��ʱ��t�仯��������ͼ��ʾ������������ȷ����
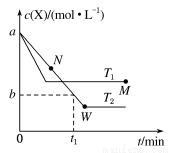
A���÷�Ӧ���е�M��ų����������ڽ��е�W��ų�����
B��T2�£���0��t1ʱ���ڣ�v(Y)�� mol��L��1��min��1
C��M�������Ӧ����v������N����淴Ӧ����v��
D��M��ʱ�ټ���һ����X��ƽ���X��ת���ʼ�С

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������������ѧ��һ��ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ͨ�����������Ļ�ѧҩƷ������ǡ���ķ����ᴿ��������ȥij��Һ���ܽ�����ʣ����������в���ȷ���ǣ������ڵ�����Ϊ���ʣ�
A | KCl��Һ��CaCl2�� | ��K2CO3��Һ�����ˣ��ټ��������� |
B | NaNO3��Һ��AgNO3�� | ������NaCl��Һ������ |
C | NaCl��Һ��I2�� | �Ӿƾ�����Һ |
D | KBr��Һ��Br2�� | ��CCl4����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�ڵ�������ѧУ�߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�?????
2010���Ϻ�������������ǡ����У�����������á�������������ȷ����
A��ijЩ�ݵ����ʹ�÷Ǿ��象Ĥ���Գ������̫����
B���������ڼ䣬���ÿɽ���ġ��������ϡ����һ���Է��У��ɷ�ֹ������ɫ��Ⱦ
C���������й��ݡ�����֮�ڡ�ʹ�õĸֽ���������ڸ߷��ӻ�����
D������ͣ������װ�������ʩ���ɽ�����β���е�CO��NO ת��Ϊ������CO2��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��ʿ���ɻ���ɽ����У�߶�������ѡ��ѧ�Ծ��������棩 ���ͣ��ƶ���
ij������X��һ����Ҫ���л�����ԭ�ϣ�����ʽC7H8��������Ϊ��ʼԭ����Ƴ�����ת����ϵͼ�����ֲ���ϳ�·�ߡ���Ӧ������ȥ��������A��һ�ȴ��F�ķ���ʽΪC7H7NO2��Y��һ�ֹ��ܸ߷��Ӳ��ϡ�
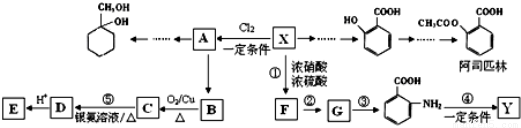
��֪������Ϣ��
��1��������ڸ�����ص������£��������������Ȼ�
��2��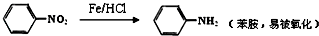
����ݱ���������Ϣ����ѧ֪ʶ�ش��������⣺
��1��X�Ľṹ��ʽ�� ����˴Ź�������ͼ�� �����շ壻
��2���л���C�Ľṹ��ʽ�� ��
��3����˾ƥ�ַ����к��еĹ����ŵ������� ��1mol��˾ƥ��������NaOH��Һ��Ӧ�������NaOH�����ʵ���Ϊ mol��
��4��Y�Ľṹ��ʽΪ ��
��5��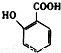 �ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯���ﹲ�� �֣�
�ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯���ﹲ�� �֣�
��6����������A���������ʺϳ� ������ͼ��
������ͼ�� ��
��
�ס��ҷ�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��ʿ���ɻ���ɽ����У��һ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A��14462Sm��15062Sm��Ϊͬλ��
B��������ʹ��ʪ�ĺ첼����ɫ��˵��������Ư����
C����1���c1mol/L��������ˮϡ��Ϊ5�����ϡ��Һ��Ũ��Ϊ0.2c1mol/L
D����ɫ��Ӧһ��������ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭����һ���鶼��������ѧ�ȸ�һ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾװ��,�ܱ������ڷֱ���������H2��O2�Ļ�������ڿ��ƶ��Ļ�������,�ڱ�״��������H2��O2�Ļ�������ȼ����,��������,�ָ�ԭ�¶Ⱥ�,�����һ�ͣ��������������,��ԭ��H2��O2���������ӽ���

A��2:7 B��4:5 C��5:4 D��7:6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����������ھ���ѧ�߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪�Ȼ�ѧ����ʽ��
H2O(g) = H2(g) + O2(g) ��H = +241.8 kJ��mol-1
O2(g) ��H = +241.8 kJ��mol-1
H2(g)+  O2(g) = H2O��1�� ��H = ��285.8 kJ��mol-1
O2(g) = H2O��1�� ��H = ��285.8 kJ��mol-1
��18gҺ̬ˮ��Ϊˮ����ʱ���������仯��
A������44 k J B������88kJ C������44kJ D������2.44 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�갲��ʡ���ǡ���Ϫ�������У�߶�������������ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��ǿ��ǿ���ϡ��Һ�����кͷ�Ӧ���к��ȡ�H=��57.3kJ/mol��C2H6��ȼ���ȡ�H=��1559.8kJ/mol��
A��H2CO3(aq) + 2NaOH(aq) = Na2CO3(aq) + 2H2O(l) ��H=��114.6kJ/mol
B��2C2H6(g) + 7O2(g) = 4CO2(g) + 6H2O(l) ��H=��3119.6kJ/mol
C��NaHCO3(aq) + NaOH(aq) = Na2CO3(aq) + H2O(l) ��H=��57.3kJ/mol
D��C2H6(g) + 7/2O2(g) = 2CO2(g) + 3H2O(g) ��H=��1559.8kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ�߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʵ�����A��B�����2 L���ܱ������У��������·�Ӧ3A(g����B(g��  xC(g����2D(g������5 min
xC(g����2D(g������5 min ����D��Ũ��Ϊ0.5 mol��L��1��c(A����c(B����3��5����C��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.1 mol��L��1��min��1�������йؽ�����ȷ����
����D��Ũ��Ϊ0.5 mol��L��1��c(A����c(B����3��5����C��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.1 mol��L��1��min��1�������йؽ�����ȷ����
A��x��ֵΪ1
B����B��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.2 mol��L��1��min��1
C����Ӧ��ʼǰA�����ʵ���Ϊ3 mol 
D��5 minʱA��Ũ��Ϊ0.2 mol��L��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com