
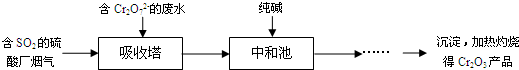
分析 (1)根据脱硫的原理,适合用作该法吸收剂的是能与SO2发生反应的物质;
(2)①二氧化硫与Cr2O72-离子发生氧化还原反应生成SO42-离子和Cr3+离子;
②碳酸盐和酸反应生成二氧化碳和水;
(3)甲烷与NOx一定条件下反应,产物为空气中含有的无害成分氮气和二氧化碳,根据得失电子守恒书写方程式.
解答 解:(1)a.石灰乳的主要成分为氢氧化钙,SO2+Ca(OH)2=CaSO3+H2O,故a正确;
b.二氧化硫与亚硫酸钠溶液反应生成亚硫酸氢钠,反应方程式为:H2O+Na2SO3+SO2═2NaHSO3,故b正确;
c.亚硫酸的酸性强于碳酸,所以二氧化硫能与Na2CO3溶液反应,SO2+Na2CO3=Na2SO3+CO2,故c正确;
d.盐酸是强酸,酸性强于亚硫酸,二氧化硫与CaCl2溶液不反应,故d错误;
故答案为:a、b、c;
(2)①重铬酸根具有强氧化性,能将二氧化硫中+4价的硫氧化为+6价,离子反应为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O,
故答案为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O;
②中和池中加入碳酸钠和酸反应,除生成Cr(OH)3沉淀外,还会产生二氧化碳气体,
故答案为:CO2;
(3)甲烷与NOx一定条件下反应,产物为空气中含有的无害成分氮气和二氧化碳,化学方程式为:4NOx+xCH4=2N2+xCO2+2xH2O,故答案为:4NOx+xCH4=2N2+xCO2+2xH2O.
点评 本题考查了硫酸工厂的烟气中烟气脱硫,涉及了二氧化硫性质、重铬酸根的强氧化性等内容的应用,侧重考查了学生的分析、理解等综合能力,注意合理分析题中信息,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
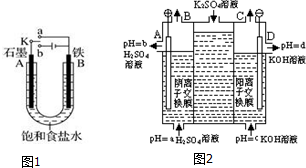
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 1 mol/L 的稀硫酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 合成氨的反应是一个放热反应,所以升高温度,反应速率减慢 | |
| C. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| D. | 汽车尾气中的 CO 和 NO 可以缓慢反应生成 N2和 CO2,减小压强,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
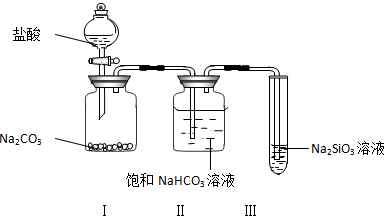
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
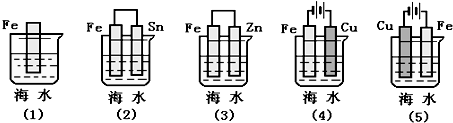
| A. | (5)(2)(1)(3)(4) | B. | (5)(1)(2)(4)(3) | C. | (4)(2)(1)(3)(5) | D. | (4)(3)(1)(2)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(NH4+) 由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | bd | B. | bc | C. | ad | D. | 只有d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com