
【题目】关于化学键的叙述中,正确的是
A. HCl电离产生H+和Cl-,可判断HCl分子中存在离子键
B. 不同元素组成的多原子分子中的化学键一定全是极性键
C. 化学键是指使原子或离子相互结合的静电吸引作用力
D. NaHSO4固体中含有的阴离子与阳离子的个数比为1∶1
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的混合气体X和铜跟浓硝酸反应产生的混合气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )

A. 洗气瓶中产生的沉淀是BaCO3
B. 在Z导管出来的气体中无CO2
C. 洗气瓶中产生的沉淀是BaSO3
D. 在Z导管口有红棕色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A.![]() Cl2与
Cl2与 ![]() Cl2氧化能力相近,二者互为同位素
Cl2氧化能力相近,二者互为同位素
B.![]() Se与
Se与 ![]() Se所含质子数相同,中子数不同
Se所含质子数相同,中子数不同
C.同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱
D.同周期主族元素形成的简单离子半径随核电荷数的增大而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃主链上有4个碳原子的同分异构体只有两种结构:含相同碳原子数,主链上也有4个碳原子的单烯烃(只含一个>C=C<的链烃) 其可能的结构有
A. 3种 B. 4 种 C. 5种 D. 6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下面两个小题:
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库.
(1)3He是高效核能原料,其原子核内中子数为
(2)Na的原子结构示意图为 ,Na在氧气中完全燃烧所得产物的电子式为 .
(3)MgCl2在工业上应用广泛,可由MgO制备.
①MgO的熔点比BaO的熔点 (填“高”或”低”).
②月球上某矿石经处理得到的MgO中含有少量SiO2 , SiO2的晶体类型为 ;所含化学键类型为 .
③MgO与碳粉和足量氯气在一定条件下反应可制备MgCl2 . 若尾气可用足量NaOH溶液完全吸收,则生成的盐有 (写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷可以发生如下反应:CH3﹣CH3+Br2→CH3CH2Br+HBr.这个反应在有机化学中属于( )
A.裂解反应
B.取代反应
C.分解反应
D.加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种工业制备SrCl6H2O的生产 流程如下:
已知:①M(SrCl26H2O)=267g/mol;
②Ksp(SrSO4)=3.3×10﹣7、Ksp(BaSO4)=1.1×10﹣10;
③经盐酸浸取后,溶液中除含有Sr2+和Cl﹣外,还含有少量Ba2+杂质.
(1)隔绝空气高温焙烧,若2mol SrSO4中只有S被还原,转移了16mol电子.写出该反应的化学方程式: .
(2)过滤2后还需进行的两步操作是、 .
(3)加入硫酸的目的是;为了提高原料的利用率,滤液中Sr2+的浓度应不高于 mol/L(注:此时滤液中Ba2+浓度为1×10﹣5 mol/L).
(4)产品纯度检测:称取1.000g产品溶解于适量水中,向其中加入含AgNO31.100×10﹣2 mol的AgNO3溶液(溶液中除Cl﹣外,不含其它与Ag+反应的离子),待Cl﹣完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000mol/L的NH4SCN标准溶液滴定剩余的AgNO3 , 使剩余的Ag+ 以AgSCN白色沉淀的形式析出.
①滴定反应达到终点的现象是 .
②若滴定过程用去上述浓度的NH4SCN溶液20.00mL,则产品中SrCl26H2O的质量百分含量为(保留4位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、O、Si、S、Al、Fe、Cu是常见的七种元素.
(1)Si位于元素周期表第周期第族.
(2)Cu原子的价层电子排布图为 .
(3)基态Fe原子有个未成对电子,Fe3+的电子排布式为 . 可用硫氰化钾检验Fe3+ , 形成的配合物的颜色为 .
(4)用“>”或“<”填空:
离子半径 | 电负性 | 熔点 | 酸性 |
O2﹣ Na+ | FO | 金刚石 晶体硅 | H2SO4HClO4 |
(5)氢元素和上述非元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键、又含有非极性共价键的化合物是(填化学式,任写一种).
(6)O和Cu形成的一种离子化合物的晶体结构如图,则铜离子的电荷为 . 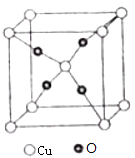
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com