

分析 (1)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯;
(2)浓硫酸具有强氧化性,能将乙醇氧化生成碳,自身被还原生成二氧化硫,二氧化硫含有还原性;
(3)乙烯和溴发生加成反应生成溴代烃,溴代烃不溶于水且密度大于水;
(4)二氧化硫属于酸性氧化物,能将二氧化硫吸收,二氧化硫能使品红溶液褪色;
(5)废液温度较高,应该冷却后再处理,烧瓶中含有浓硫酸,具有腐蚀性,所以要集中处理.
解答 解:(1)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯,反应方程式为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑,
故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑;
(2)浓H2SO4具有强氧化性,将乙醇氧化成碳,自身被还原生成二氧化硫,C+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,SO2具有还原性,可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴褪色,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,
故选:BC;
(3)溴水中的溴与反应生成的乙烯发生加成反应,方程式为:CH2=CH2+Br2→CH2BrCH2Br,1,2-二溴乙烷密度大于水在试管底层为油状物质;
故答案为:液体分两层,下层有油状液体;
(4)二氧化硫能和溴发生氧化还原反应而使溴水褪色,从而干扰乙烯的检验,二氧化硫属于酸性氧化物,能和碱反应生成盐,为防止二氧化硫干扰乙烯的检验,可以用氢氧化钠溶液除去二氧化硫,二氧化硫能使品红溶液褪色,所以可以用品红溶液检验二氧化硫,实验时要先吸收二氧化硫,再检验二氧化硫是否被除尽,则A中的试剂是NaOH溶液,B中液体是品红溶液,
故答案为:NaOH溶液;吸收SO2;品红溶液;
(5)实验后的烧瓶温度较高,为防止炸裂烧瓶,不能向烧瓶中加入水,要自燃冷却烧瓶至室温,烧瓶中含有浓硫酸,具有强腐蚀性,不能随便倾倒,要倒入废液缸中集中处理,
故选B.
点评 本题考查了实验室制取乙烯实验,明确实验原理是解本题关键,根据浓硫酸、乙烯的性质来分析解答,注意二氧化硫、乙烯都能使溴水褪色,但褪色原理不同,乙烯使溴水褪色是发生了加成反应,二氧化硫使溴水褪色是发生了氧化还原反应,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
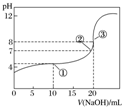
| A. | 该中和滴定过程,最宜用石蕊作指示剂 | |
| B. | 图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 | |
| C. | 滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在 | |
| D. | 图中点②所示溶液中,c(CH3COO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若浓硫酸不慎洒落在皮肤上应立即用干布拭去,再用大量水冲洗 | |
| B. | 可使蔗糖变黑,体现了浓硫酸的吸水性 | |
| C. | 常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 | |
| D. | 可使胆矾变白,体现了浓硫酸的脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 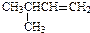 2-甲基-3-丁烯 2-甲基-3-丁烯 | B. | 乙炔的结构简式:CHCH | ||
| C. | 乙醚的分子式:C 2H 6O | D. | 甲基的电子式: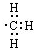 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步骤 | 操作 | 现象 |
| (1) | 取少量溶液滴加几滴石蕊试液 | 溶液变蓝 |
| (2) | 另取少量溶液滴加过量氯水,再加入CCl4振荡,静置 | 上层无色,下层呈紫色 |
| (3) | 取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3,过滤 | 有白色沉淀产生 |
| (4) | 向(3)的滤液中加入过量AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | 可能含有 Cl-、SO32-、SO42- | B. | 肯定没有 Ba2 +、Cl-、I- | ||
| C. | 不能确定 Na+、SO32-、SO42- | D. | 肯定含有 Na+、I-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质分子中一定不存在共价键 | |
| B. | 气态物质中一定有共价键 | |
| C. | 在共价化合物中一定有共价键 | |
| D. | 由非金属元素组成的化合物中,一定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 689 | 533 | 409 |
| A. | 反应I2 (aq)+I-(aq)?I3-(aq)的△H>0 | |
| B. | 其他条件不变,升高温度,溶液中c(I3-)减小 | |
| C. | 在上述平衡体系中加入苯,平衡不移动 | |
| D. | 25℃时向溶液中加入少量KI固体,平衡常数K大于689 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com