
| A.乙烷和Cl2取代 | B.乙烯和Cl2加成 |
| C.乙烯和HCl加成 | D.乙烯和H2加成后再与Cl2取代 |
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:不详 题型:实验题
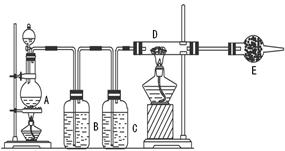
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
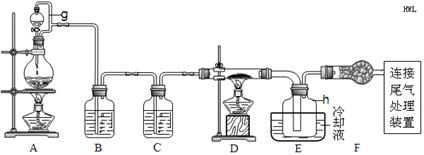
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | — | 315 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
 5Fe3++Mn2++4H2O
5Fe3++Mn2++4H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1: 4 | B.1: 5 | C.2: 1 | D.2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 途径 | 生成1 mol Al(OH)3消耗H+或OH-的物质的量/mol | |
| 消耗H+ | 消耗OH- | |
| 1.Al→Al3+→Al(OH)3 | | |
2.Al→AlO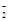 →Al(OH)3 →Al(OH)3 | | |
3.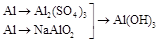 | | |
 (g)NaOH固体。他在托盘天平的右盘上放入(
(g)NaOH固体。他在托盘天平的右盘上放入(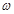 + y)(g)砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边,如图所示,下面他的操作应该是_________ 使 。
+ y)(g)砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边,如图所示,下面他的操作应该是_________ 使 。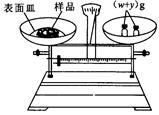
 (g)NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液过程示意图中有错误的是(填操作序号)______________。
(g)NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液过程示意图中有错误的是(填操作序号)______________。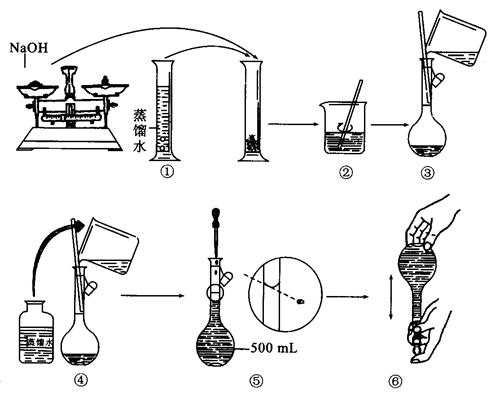
 NaOH溶液,再加入足量铝屑。给溶液稍加热。其作用是:__________________________用蒸馏水把铝屑冲洗干净。称量铝屑的质量为m1(g)。
NaOH溶液,再加入足量铝屑。给溶液稍加热。其作用是:__________________________用蒸馏水把铝屑冲洗干净。称量铝屑的质量为m1(g)。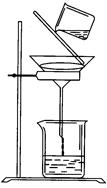
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④⑤ | B.②④⑤③① | C.④②③①⑤ | D.②④①⑤③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com