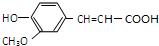
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g)+2B(g)=4C (g)△H>0 达到平衡时,c(A)=2mol?L
-1,c(B)=7mol?L
-1,c(C)=4mol?L
-1.试确定B的起始浓度c(B)的取值范围是
3mol/L≤c(B)≤9mol/L
3mol/L≤c(B)≤9mol/L
;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是
C
C
.
A.增加C的物质的量 B.加压 C.升温 D.使用催化剂
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是
B
B
( 填“A”或“B”). 设盐酸中加入的Zn质量为m
1,醋酸溶液中加入的Zn质量为 m
2. 则 m
1<
<
m
2 ( 选填“<”、“=”、“>”)
(3)在体积为3L的密闭容器中,CO与H
2在一定条件下反应生成甲醇:CO(g)+2H
2(g)→CH
3OH(g).反应达到平衡时,平衡常数表达式K=
,升高温度,K值
减小
减小
(填“增大”、“减小”或“不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H
2)=
.
(4)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:
Cu(OH)
2(s)=Cu
2+(aq)+2OH
-(aq),K
sp=c(Cu
2+)[c(OH
-)]
2=2×10
-20当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO
4溶液里c( Cu
2+)=0.02mol?L
-1,如果生成Cu(OH)
2沉淀,应调整溶液pH,使之大于
5
5
; 要使0.2mol?L
-1的CuSO
4 溶液中Cu
2+沉淀较为完全 (使Cu
2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为
6
6
.
(5)常温下,某纯碱(Na
2CO
3) 溶液中滴入酚酞,溶液呈红色.则该溶液呈
碱性
碱性
性.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na
2CO
3电离出的CO
32-水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确
向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确
.

 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
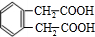
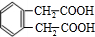
 +3Na2CO3→+3NaHCO3
+3Na2CO3→+3NaHCO3 +3Na2CO3→+3NaHCO3
+3Na2CO3→+3NaHCO3