
| A. | NH3(g)+HCl(g)→NH4Cl(s),该反应可自发进行,故熵值增大 | |
| B. | SO2(g)→S(s)+O2(g)△H>0,△S<0.则该反应能自发进行 | |
| C. | O2(g)+2H2(g)═2H2O(l)△H<0,恒温恒压下一定能自发进行 | |
| D. | 某温度下2SO2(g)+O2(g)═2SO3(g),K1=400,则相同温度下2SO3(g)?2SO2(g)+O2(g)的平衡常数为$\frac{1}{400}$ |
分析 A、依据△H-T△S<0,反应自发进行,反应前后气体体积减小,熵值减小;
B、依据△H-T△S<0,反应自发进行分析判断;
C、反应是气体体积减小的放热反应,依据△H-T△S<0,反应自发进行;
D、正逆反应的平衡常数互为倒数.
解答 解:A、依据△H-T△S<0,反应自发进行,反应前后气体体积减小,熵值是减小的反应,故A错误;
B、依据△H-T△S<0,反应自发进行分析判断,△H>0,△S<0.△H-T△S>0,则该反应不能自发进行,故B错误;
C、反应是气体体积减小的放热反应,依据△H-T△S<0,反应自发进行,反应△H<0,△S<0,低温下一定能自发进行,故C错误;
D、正逆反应的平衡常数互为倒数,某温度下2SO2(g)+O2(g)═2SO3(g),K1=400,则相同温度下2SO3(g)?2SO2(g)+O2(g)的平衡常数为$\frac{1}{400}$,故D正确;
故选D.
点评 本题考查了反应自发进行的判断依据和反应焓变熵变的比较分析,平衡常数概念的实质理解应用,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠和金刚石 | B. | 晶体硅和水晶 | C. | 冰和干冰 | D. | 苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2固体不导电,但在熔融状态下可以导电 | |
| B. | CaCl2的水溶液能导电 | |
| C. | CaCl2易溶于水 | |
| D. | CaCl2在有机溶剂(如苯)中的溶解度极小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL | |
| B. | 当金属全部溶解时收集到NO气体的体积为0.336L(标准状况下) | |
| C. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol | |
| D. | 参加反应的金属的总质量一定是9.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其化学键的类型为离子键、共价键.
,其化学键的类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag是还原剂 | B. | 银针验毒时,空气中氧气失去电子 | ||
| C. | 反应中Ag和H2S均是还原剂 | D. | Ag2S既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
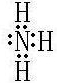 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com