
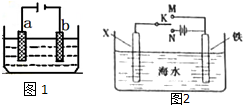
 电化学原理在工业生产中有重要应用.如图1所示电解池中:
电化学原理在工业生产中有重要应用.如图1所示电解池中:分析 (1)电解饱和氯化钠溶液时,由电源可知,b为阴极,a为阳极,阳极上是氯离子离子失电子,阴极上是氢离子得电子,据此分析;
(2)电解精炼银时,粗银作阳极,若b极有少量红棕色气体生成,则b电极上硝酸根离子得电子生成二氧化氮;
(3)作原电池正极或作电解池阴极的金属被保护.
解答 解:(1)电解饱和氯化钠溶液时,由电源可知,b为阴极,阴极上是氢离子得电子,反应为2H++2e-=H2↑,a为阳极,阳极上是氯离子离子失电子,反应为2Cl--2e-=Cl2↑,
①b为阴极,阴极上是氢离子得电子发生还原反应,反应为2H++2e-=H2↑,所以氢氧根显碱性,所以电极b周围首先变红色,故答案为:b;还原;
②a为阳极,阳极上是氯离子离子失电子,反应为2Cl--2e-=Cl2↑,检验氯气用用湿润的淀粉碘化钾试纸检验,看是否变蓝;
故答案为:用湿润的淀粉碘化钾试纸检验,看是否变蓝;
③阳极上是氯离子离子失电子,阴极上是氢离子得电子,电解总反应离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(2)电解精炼时,粗银做阳极,所以粗银是a极;b电极是阴极,发生还原反应,生成了红棕色气体是NO2,电极反应:NO3-+e-+2H+=NO2↑+H2O,
故答案为:a;NO3-+e-+2H+=NO2↑+H2O;
(3)作原电池正极或作电解池阴极的金属被保护,若X为碳棒,为减缓铁的腐蚀,则铁应作电解池阴极,所以开关K应该置于处N处;
若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法,
故答案为:N;牺牲阳极的阴极保护法.
点评 本题考查学生电解池的工作原理知识及其应用,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其密度之比等于物质的量之比 | |
| B. | 其密度之比等于摩尔质量之比 | |
| C. | 等质量的三种气体,其体积比等于相对分子质量之比 | |
| D. | 等体积的三种气体,其物质的量之比等于相对分子质量之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂会使K变化但△H不变 | |
| B. | 使用催化剂会使△H增大,但K不变 | |
| C. | 使用催化剂和提高温度均可增大H2的转化率 | |
| D. | 在一密闭容器中,投入浓度均为1mol•L-1的 N2、H2、NH3,平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 性质 | 8O | 16S | Se | 52Te |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1 390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径(nm) | 0.074 | 0.102 | 0.116 | 0.143 |
| 单质与H2反应 | 点燃易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从溴水中提取溴,可加入酒精作萃取剂 | |
| B. | 萃取操作完成后,静置分液,上、下层液体均从下口放出 | |
| C. | 用一种有机溶剂,提取水溶液中的某物质,静置分液后,“水层”应在上层 | |
| D. | 萃取时,所加入的溶剂应与原溶剂互不相溶,且与溶质相互间不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCHCl3中含有的氯原子的数目为3NA | |
| B. | 25℃、101kPa下,16gO3和O2混合气体中含有的氧原子数为NA | |
| C. | 等质量的N2和CO所含分子数相同且均为NA | |
| D. | 一定温度下,1L 1mol•L-1的CH3COONa溶液含NA个CH3COO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com