
| A、2mol?L-1 |
| B、1mol?L-1 |
| C、0.5mol?L-1 |
| D、0.05mol?L-1 |
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、③ | B、② | C、②和④ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
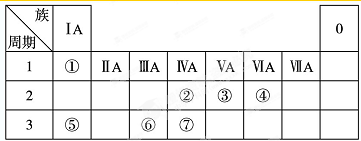
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:HI<HBr<HCl<HF |
| B、原子半径:K>Cl>S |
| C、分子稳定性:HF>HCl>HBr>HI |
| D、单质熔点:Li<Na<K<Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | Cl- | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| ③ | KClO3 | 浓盐酸 | Cl2 |
| A、表中①组反应可能有一种或两种元素被氧化 |
| B、表中②组反应的离子方程式是2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
| C、表中③组反应的还原产物是KCl,电子转移数目是6e- |
| D、氧化性强弱比较:KClO3>Fe3+>Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅是生产光纤制品的基本原料 |
| B、铝热反应可用于焊接铁轨 |
| C、盐析可提纯蛋白质并保持其生理活性 |
| D、常温下可用铁罐槽车运输浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石英光导纤维,在遇到强碱或氢氟酸时均可能发生“断路” |
| B、葡萄糖既能发生银镜反应,又能发生水解反应 |
| C、浓硝酸和醋酸铅溶液均可使鸡蛋清溶液中的蛋白质变性 |
| D、1mol油脂完全水解的产物是1mol甘油和3mol高级脂肪酸(或盐) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com