
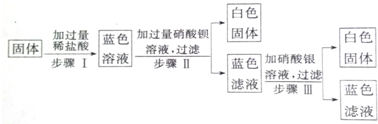
分析 根据固体加过量稀盐酸,固体完全溶解且溶液呈蓝色,说明固体中一定有硝酸铜;又因为无气泡产生,所以固体中一定不含有碳酸氢钠;步骤Ⅱ加入过量硝酸钡产生白色沉淀,说明固体中一定含有硫酸钠;步骤Ⅲ中加入硝酸银溶液,出现白色沉淀,则该白色沉淀为氯化银,由于一开始加入过量稀盐酸,所以溶液中一定有氯离子,所以会生成氯化银沉淀,但不能确定一定含有氯化钠.
解答 解:(1)固体加过量稀盐酸,固体完全溶解且溶液呈蓝色,说明固体中一定有硝酸铜;步骤Ⅱ加入过量硝酸钡产生白色沉淀,说明固体中一定含有硫酸钠,
故答案为:Cu(NO3)2、Na2SO4;
(2)固体加过量稀盐酸无气泡产生,所以固体中一定不含有NaHCO3,故答案为:NaHCO3;
(3)根据向固体加过量稀盐酸,固体完全溶解且溶液呈蓝色,说明固体中一定有硝酸铜,硝酸铜溶于水,所以蓝色滤液中一定含有硝酸铜和硝酸;加入过量硝酸钡,说明硝酸钡有剩余,所以蓝色滤液中一定含有硝酸钡;硝酸钡和硫酸钠反应生成硝酸钠和硫酸钡沉淀,化学方程式是Ba2++SO42-=BaSO4↓,最后加入硝酸银,产生的白色沉淀是
氯化银,即Cl-+Ag+=AgCl↓,故答案为:Ba2++SO42-=BaSO4↓;Cl-+Ag+=AgCl↓;
(4)根据向固体加过量稀盐酸,固体完全溶解且溶液呈蓝色,说明固体中一定有硝酸铜,硝酸铜溶于水,所以蓝色滤液中一定含有硝酸铜和硝酸;加入过量硝酸钡,说明硝酸钡有剩余,所以蓝色滤液中一定含有硝酸钡;硝酸钡和硫酸钠反应生成硝酸钠和硫酸钡沉淀,所以蓝色滤液中一定含有硝酸钠,综合分析可知,蓝色滤液中一定含有的溶质是:硝酸、硝酸钠、硝酸钡、硝酸铜.
故答案为:Ba(NO3)2、Cu(NO3)2、NaNO3、HNO3.
点评 在解此类题时,首先分析所给混合物中各物质的性质,然后根据题中所给的实验现象进行判断,最后确定混合物的组成成分.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:选择题
| A. | 水泥、陶瓷、玻璃是三大重要的硅酸盐产品 | |
| B. | 水玻璃是建筑行业经常使用的黏合剂 | |
| C. | 高纯度的硅被用于制作光导纤维 | |
| D. | 水晶、石英的主要成分是SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至10倍后pH=4 | |
| C. | 0.2 mol•L-1的盐酸与等体积水混合后pH=1 | |
| D. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 水/硝酸钙 | 0.8:1 | 0.9:1 | 0.95:1 | 1:1 | 1.05:1 | 1.1:1 | 1.15:1 |
| 浸出率/% | 83.1 | 94.5 | 98.2 | 99.1 | 99.5 | 99.6 | 99.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 60% | C. | 40% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 加入氢氧化钠溶液,通过分液的方法,可以除去苯中的乙酸 | |
| C. | 将氢气和氧气的混合气体通过灼热的氧化铜,以除去其中的氢气 | |
| D. | 用萃取的方法分离汽油和煤油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com