
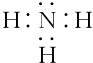 .
.分析 A的原子中没有成对电子,所以A是氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,所以B的核外电子排布为:1s22s22p2,是碳元素,D原子最外层电子数是内层电子数的3倍,所以D是氧元素;则C是氮元素;D与G处在同一族,所以G是硫元素;F是地壳中含量最高的金属元素,则F是铝元素,由此分析解答.
解答 解:(1)元素铝在周期表中的位置第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)N原子最外层p电子半满,为稳定结构,非金属性强的第一电离能大,则第一电离能由大到小的顺序为N>O>C,故答案为:N>O>C;
(3)因为Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,根据相似相溶原理知,固态Ni(CO)4属于分子晶体,故答案为:分子晶体;
(4)氨气分子的电子式为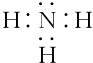 ,故答案为:
,故答案为: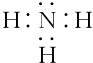 ;
;
(5)ED是MgO,MgO晶体中离子的电荷数大于NaCl,离子半径小,MgO离子键的键能更大,熔点更高.
故答案为:MgO晶体中离子的电荷数大于NaCl,离子间的平均距离小于NaCl,离子键的键能更大,熔点更高(晶格能大);
(6)由H、O、S中任两种元素构成甲、乙两种均含18个电子的分子,所含原子的数目依次为3、4,所以甲是硫化氢、乙是过氧化氢,①硫化氢中硫是sp3杂化; ②1mol过氧化氢分子含有3molmolσ键,故答案为:sp3;3.
点评 本题考查原子结构与性质,明确元素的位置、结构、性质是解答的关键,难度中等,电子排布式、杂化类型、晶体类型与性质是高考中常考的考点.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性:N<O<F | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 热稳定性:HF>HCl>H2S | D. | 原子半径:Al>Mg>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.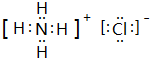 ,A2C2的电子式为
,A2C2的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂.20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键步骤:
金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂.20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键步骤:| 实验组别 | 1 | 2 | 3 | 4 |
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| O2生成量/(10-6mol) | 3.6 | 4.4 | 4.5 | 1.5 |
| 反应时间/h | 3 | 3 | 3 | 3 |
| 容器体积/L | 2 | 2 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A+m}$(A+N+m)mol | B. | $\frac{a}{A+m}$(A-N+m)mol | C. | $\frac{a}{A+m}$( A-N)mol | D. | $\frac{a}{A+m}$(A-N)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | WX2、WZ2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2的化学键类型和晶体类型都相同 | |
| C. | X的氢化物的熔沸点比Z的氢化物的熔沸点高 | |
| D. | 原子半径大小顺序为X<W<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
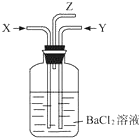 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )| A. | 在Z导管口有红棕色气体出现 | |
| B. | 洗气瓶中产生的沉淀是BaCO3和BaSO3的混合物 | |
| C. | 洗气瓶中产生的沉淀是BaSO3 | |
| D. | 在Z导管出来的气体中无CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com