
某结晶水合物的化学式为R•nH2O,其式量为M.25℃时,将ag该晶体溶于bg水中可形成VmL饱和溶液.下列关系中正确的是( )
|
| A. | 饱和溶液的物质的量浓度为c= |
|
| B. | 25℃时R的溶解度为S= |
|
| C. | 饱和溶液中溶质的质量分数为W= |
|
| D. | 饱和溶液的密度为ρ= |
| 物质的量浓度的相关计算.. | |
| 专题: | 物质的量浓度和溶解度专题. |
| 分析: | A.根据n=计算R•nH2O的物质的量,而n(R)=n(R•nH2O),根据c=计算该饱和溶液的物质的量浓度; B.根据化学式计算结晶水的质量、R的质量,进而计算溶液中水的总质量,计算100g溶解R的质量即为溶解度; C.根据w(溶质)= D.溶液总质量为(a+b)g,根据ρ=计算溶液密度,或利用c= |
| 解答: | 解:A.n(R)=n(R•nH2O)=mol,该饱和溶液的物质的量浓度 B.R的质量为 C.根据w(溶质)= D.溶液总质量为(a+b)g,根据ρ=可知,溶液密度为 故选C. |
| 点评: | 本题考查溶液浓度计算,涉及物质的量浓度、质量分数、溶解度,属于字母型计算,为易错题目,注意对基础知识的理解掌握. |


科目:高中化学 来源: 题型:
某有机物的分子式为C11H16,分析数据表明其分子中有两个—CH3、两个—CH2—、一个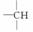 和一个
和一个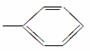 ,则该有机物可能的结构有(不考虑立体异构) ( )。
,则该有机物可能的结构有(不考虑立体异构) ( )。
A.2种 B.3种
C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
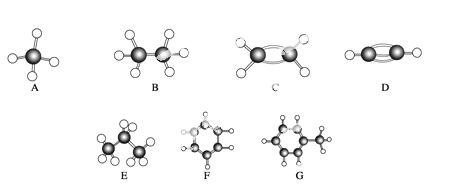
(1)常温下含碳量最高的气态烃是(填对应字母)___________;
(2)能够发生加成反应的烃有(填数字)________ 种;
种;
(3)一卤代物种类最多的是(填对应字母)________;
(4)写 出实验室制取C的化学方程式____________________________________;
出实验室制取C的化学方程式____________________________________;
(5)写出F发生溴代反应的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上利用氨催化氧化后,经过一系列反应可以制备硝酸。
 (1)氨气催化氧化的化学方程式为
(1)氨气催化氧化的化学方程式为
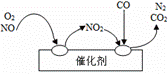
(2)给汽车安装尾气净化装置。净化装置里装有催化
剂,气体在催化剂表面吸附与解吸作用的机理如右
 图所示。写出净化过程中的总化学反应方程
图所示。写出净化过程中的总化学反应方程
式: 。
(3)目前,科学家正在研究一种以乙烯作为还原剂的
脱硝(NO)原理,其脱硝机理示意图如下图。写
出该脱硝原理总反应的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 向Fe(OH)3胶体溶液中逐滴加入稀硫酸,会逐渐生成红褐色沉淀,当稀硫酸过量,又变成棕黄色溶液,整个过程发生的都是化学变化 |
|
| B. | 某些蛋白质可以分散在溶剂中形成分子胶体,乙醇能使蛋白质变性 |
|
| C. | 不同的气体,若体积不同,则它们所含的分子数也不会相同 |
|
| D. | 有化学键断裂或形成的变化一定是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
白藜芦醇广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1摩尔该化合物起反应的Br2或H2的最大用量分别是( )
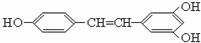
|
| A. | 1摩尔 1摩尔 | B. | 3.5摩尔 7摩尔 | C. | 3.5摩尔 6摩尔 | D. | 6摩尔 7摩尔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ti、Fe、Cr、Mn等均为过渡元素,在生产生活中起着不可替代的重要作用,对其单质和化合物的应用研究是目前科学研究的前沿之一.请回答下列问题:
(1)Cr元素(核电荷数为24)的基态原子电子排布式为 ,这一排布方式符合 (填原理或规则),比较Fe和 Mn的各级电离能后发现,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子 (填“难”或“易”).(每空两分,共6分)
(2)过渡元素有着与主族元素不同的价电子构型,其中外围电子构型为4f75d16s2的元素在周期表中处在 族,该族元素共有 种.
(3)某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应(巨磁电阻效应).用A、B、O表示这类特殊晶体的化学式: .
(4)有一种蓝色晶体可表示为:[KxFey(CN)z],研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,K+位于上述晶胞体心,且K+空缺率为50%(体心中没有K+的占总体心的百分比),其晶体中的阴离子晶胞结构如图2所示,该晶体的化学式可表示为
.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:CH3—CH===CH2+HBr—→CH3—CHBr—CH3(主要产物),1 mol某烃A充分燃烧后可以得
到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下图所示的一系列变化。
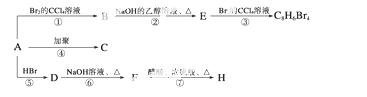
(1 )A的化学式:________,A的结构简式:________。
)A的化学式:________,A的结构简式:________。
(2)上述反应中,①是________反应,⑦是________反应。(填反应类型)
(3)写出C、D、E、H物质的结构简式:
C____________________,D____________________,
E____________________,H____________________。
(4)写出D—→F反应的化学方程式________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com