
| A. | SO2只是氧化产物 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1mol Cu2S,有4mol硫元素被氧化 | |
| D. | 每转移0.6mol电子,有0.2mol铜元素被还原 |
分析 2CuFeS2+O2=Cu2S+2FeS+SO2,Cu、O元素的化合价降低,S元素的化合价升高,该反应中转移6e-,以此来解答.
解答 解:A.O元素的化合价降低,S元素的化合价升高,对应的SO2既是氧化产物又是还原产物,故A错误;
B.CuFeS2中,Cu元素的化合价降低,S元素的化合价升高,既作还原剂也作氧化剂,硫元素被氧化,故B错误;
C.每生成1molCu2S,由反应可知,生成1molSO2,则有1mol硫被氧化,故C错误;
D.由反应可知,2Cu被还原时该反应中转移6mole-,则每转移0.6mol电子,有0.2mol铜元素被还原,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念及分析与应用能力的考查,注意元素化合价的判断,题目难度不大.


科目:高中化学 来源: 题型:填空题
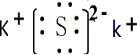 ,属于离子晶体.
,属于离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝与过量氨水:Al3++4OH-═AlO2-+H2O | |
| B. | 钠和冷水反应:Na+2H2O═Na++2OH-?+H2↑ | |
| C. | 氯气与水反应Cl2+H2O?Cl-+H++HClO | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1L pH=ll的CH3COONa溶液中水电离出的OH-的数目为0.001NA | |
| B. | 28g乙烯和丙烯的混合气体含有的原子个数为3NA | |
| C. | 1 mol/L-l NaHCO3溶液中含有HCO3-数目小于NA | |
| D. | 6.8g液态KHSO4中含有0.1NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制自来水管不能与铜制水龙头连接 | |
| B. | 红热的铁丝与水接触,表面形成蓝黑色的保护层 | |
| C. | 白铁表面有划损时,也能阻止铁被腐蚀 | |
| D. | 家用炒菜铁锅用水清洗放置后,出现红棕色的锈渍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com