
【题目】以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁[Mgx(CO3)y(OH)z·wH2O]的主要流程如图:

(1)“溶解”时,加快溶解速率的措施有_______________(写一条)。
(2)“滤液”中的溶质主要有______________(写化学式)。
(3)已知高温煅烧碱式碳酸镁可得到MgO。请写出煅烧碱式碳酸镁发生的化学方程式___。
【答案】搅拌 NH4Cl 2Mgx(CO3)y(OH)z·wH2O ![]() 2x MgO + 2y CO2 ↑ + (z+2w) H2O
2x MgO + 2y CO2 ↑ + (z+2w) H2O
【解析】
水溶解后得到以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁[Mgx(CO3)y(OH)z·wH2O]氯化镁溶液,向氯化镁溶液中通入氨气、加入碳酸氢铵,加热,反应能生成碱式碳酸镁和氯化铵,过滤后滤液的主要溶质是氯化铵,铵根离子能和显碱性的物质反应生成氨气,氧化钙能和水反应生成显碱性的氢氧化钙溶液,可以用氧化钙和水反应生成的氢氧化钙,结合铵根离子生成氨气循环使用,据此分析。
(1)搅拌能加快水分子运动速度,也就能加快水氯镁石与水的接触机会,从而加快了水氯镁石溶解速率,故答案为:搅拌;
(2)上述流程中,滤液中溶质的主要成分是NH4Cl;
(3)已知高温煅烧碱式碳酸镁可得到MgO,同时生成CO2和水,故煅烧碱式碳酸镁发生的化学方程式为2Mgx(CO3)y(OH)z·wH2O ![]() 2x MgO + 2y CO2 ↑ + (z+2w) H2O。
2x MgO + 2y CO2 ↑ + (z+2w) H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是()

A. d点对应的溶液中:K+、NH4+、CO32﹣、I﹣
B. c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
C. b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
D. a点对应的溶液中:Na+、K+、SO42﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数的值,则关于热化学方程式C2H2(g)+![]() O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
A.当10NA个电子转移时,该反应吸收1300 kJ的能量
B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量
C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,![]() ,下列说法正确的是
,下列说法正确的是
A.用![]() 的盐酸滴定
的盐酸滴定![]() 的氨水时,可用酚酞作指示剂
的氨水时,可用酚酞作指示剂
B.![]() 的醋酸与
的醋酸与![]() 的氢氧化钠溶液等体积混合,所得溶液中:
的氢氧化钠溶液等体积混合,所得溶液中:![]()
C.![]() 的盐酸与
的盐酸与![]() 的氨水等体积混合,所得溶液中:
的氨水等体积混合,所得溶液中:![]()
D.![]() 的醋酸与
的醋酸与![]() 的氨水等体积混合,所得溶液中由水电离出的
的氨水等体积混合,所得溶液中由水电离出的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳来衡量(总有机碳=水样中有机物所含碳元素的质量/水样的体积)。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。
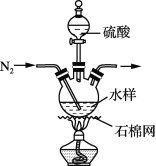
步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置见上图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热充分反应,生成的CO2完全被100 mL 0.205 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500 mL溶液。量取25.00 mL溶液于锥形瓶中,加入指示剂,并滴加0.050 00 mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4=BaC2O4↓+2H2O。恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是__________________________________。
(2)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。_______________
(3)用上述实验方法测定的水样总有机碳一般低于实际值,其原因可能是(写出一条即可)____
(4)高温燃烧可将水样中的碳酸盐、碳酸氢盐和有机物所含碳元素转化为CO2,结合高温燃烧的方法,改进上述实验。
①请补充完整改进后的实验方案:取V L的水样,分为两等份;将其中一份水样高温燃烧,测定生成CO2的物质的量为n1 mol;__________,测定生成CO2的物质的量为n2 mol。
②利用实验数据计算,所取水样的总有机碳为_____________mg·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:3A(g) ![]() 3B+C△H > 0,随着温度升高,气体平均分子质量有变小趋势,则下列判断正确的是( )
3B+C△H > 0,随着温度升高,气体平均分子质量有变小趋势,则下列判断正确的是( )
A.若C为固体,则B一定是气体B.B和C一定都是固体
C.B和C可能都是固体D.B和C不可能都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2=P4O10,已知断裂下列化学键需要吸收的能量分别为:P-P a kJ/mol、P-O b kJ/mol、P=O c kJ/mol、O=O d kJ/mol。根据有关数据和右图所示的分子结构估算该反应的H,其中正确的是( )

A.(6a+5d-4c-12b)kJmol-1B.(4c+12b-6a-5d) kJmol-1
C.(4c+12b-4a-5d) kJmol-1D.(4a+Sd-4c-12b) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是( )
①C(s)+O2(g)=CO2(g) △H1 C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A.①②④B.①③④C.②③④D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com