
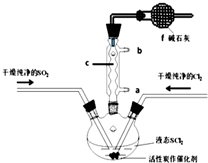
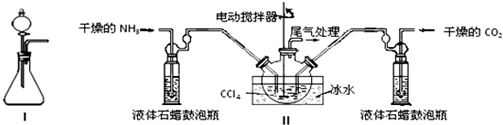
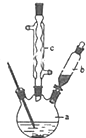
 SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 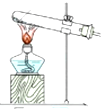 |  | 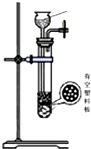 | 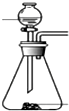 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO | 70%H2SO4+K2SO3 |
分析 (1)碱石灰与气体反应;
(2)实验室利用MnO2、4HCl(浓)制备氯气;
(3)SOCl2与水反应的方程式为:SOCl2+H2O=SO2↑+2HCl↑,AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl溶于水呈酸性抑制水解发生;
(4)丁中固体与液体反应制取二氧化硫比较合理,制取气体需要纯净,操作简单;
(5)已知氯化亚砜沸点为77℃,已知SCl2的沸点为50℃,所以采用分馏的方法即可将之分离.消耗氯气为$\frac{0.896L}{22.4L/mol}$=0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,以此来解答;
(6)先加硝酸钡,且排除干扰离子,再加硝酸银观察是否生成白色沉淀检验氯离子.
解答 解:(1)仪器c是球形冷凝管,f有两个作用一个是防止有毒的氯气与二氧化硫逸出对实验人员的身体健康造成威胁,一个是防止空气中的水蒸气进入烧瓶中使氯化亚砜水解,
故答案为:吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解;
(2)实验室氯气制备的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)SOCl2与水反应的方程式为:SOCl2+H2O=SO2↑+2HCl↑,AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl溶于水呈酸性抑制水解发生,
故答案为:SOCl2+H2O=SO2↑+2HCl↑;AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解;
(4)因为甲中加热亚硫酸氢钠确实会产生二氧化硫,但是同时也会生成水,所以向下倾斜试管自然是不行.乙中18.4mol/L的硫酸太浓,其中水分过少硫酸任然以分分子形式存在,无法与铜反应制取二氧化硫.乙中无论是浓硝酸还是稀硝酸都具有很强的氧化性可以轻易的将亚硫酸钠中的正4价的硫氧化为正6价的硫酸根离子而无法得到二氧化硫.丁中反应生成硫酸钾与二氧化硫还有水,丁制取二氧化硫比较合理,
故答案为:丁;
(5)已知氯化亚砜沸点为77℃,已知SCl2的沸点为50℃,所以采用分馏的方法即可将之分离;消耗氯气为$\frac{0.896L}{22.4L/mol}$=0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,则SOCl2的产率为$\frac{4.76g}{0.08mol×119g/mol}$×100%=50%,
故答案为:蒸馏;50%;
(6)向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,含亚硫酸根离子和氯离子,检验溶液w中存在的Cl-的方法是取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置.取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-,
故答案为:取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置,取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-.
点评 本题考查物质的制备实验,为高考常见题型,把握制备实验及发生的反应为解答的关键,侧重于学生的分析能力和实验能力的考查,注意常见气体的制备原理及应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1.8×10-13 mol•L-1 | B. | 7.3×10-13 mol•L-1 | ||
| C. | 2.3 mol•L-1 | D. | 3.7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
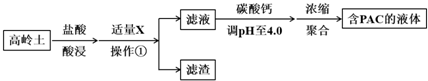
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| H2C2O4 | 无色晶体 | K1=5.9×10-2,K2=6.4×10-5,能溶于水和乙醇 |
| Na2C2O4 | 白色晶体 | 微溶于水,pH=7.2,不溶于乙醇 |
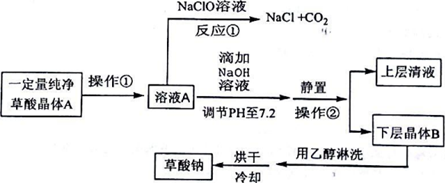
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
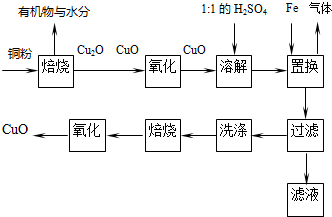
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱之一.下面是它的一种实验室合成路线: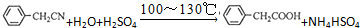

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L Na2CO3溶液中的Na+ 数目为2NA | |
| B. | 标准状况下,11.2L CCl4所含分子数为0.5NA | |
| C. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.2NA | |
| D. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com