
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成NH3的反应
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
【答案】C
【解析】
A. NO2气体中存在2NO2![]() N2O4,增大压强,缩小容器的体积,气体浓度增大,即气体颜色加深,增大压强,平衡向正反应方向进行,N2O4为无色气体,即气体颜色变浅,可以用勒夏特列原理解释,故A不符合题意;
N2O4,增大压强,缩小容器的体积,气体浓度增大,即气体颜色加深,增大压强,平衡向正反应方向进行,N2O4为无色气体,即气体颜色变浅,可以用勒夏特列原理解释,故A不符合题意;
B. 合成氨气:N2(g)+3H2(g) ![]() 2NH3(g),增大压强,平衡向正反应方向进行,可以用勒夏特列原理解释,故B不符合题意;
2NH3(g),增大压强,平衡向正反应方向进行,可以用勒夏特列原理解释,故B不符合题意;
C. H2和I2反应H2(g)+I2(g) ![]() 2HI(g),增大压强平衡不移动,增大压强缩小容器的体积,组分浓度增大,则气体颜色变深,不能用勒夏特列原理解释,故C符合题意;
2HI(g),增大压强平衡不移动,增大压强缩小容器的体积,组分浓度增大,则气体颜色变深,不能用勒夏特列原理解释,故C符合题意;
D.氯水中存在:Cl2+H2O ![]() H++Cl-+HClO,见光2HClO=2HCl+O2↑,减小生成物浓度,促使平衡向正反应方向进行,即氯水颜色变浅,可以用勒夏特列原理解释,故D不符合题意;
H++Cl-+HClO,见光2HClO=2HCl+O2↑,减小生成物浓度,促使平衡向正反应方向进行,即氯水颜色变浅,可以用勒夏特列原理解释,故D不符合题意;
答案:C。


科目:高中化学 来源: 题型:
【题目】有机物X和Y可作为“分子伞”给药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
X(C24H40O5):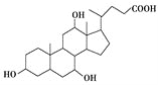
Y:H2NCH2CH2CH2NHCH2CH2CH2CH2NH2
下列叙述错误的是( )
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y与癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。
(查阅资料)
物质 | BaSO4 | BaCO3 | AgI | AgCl |
溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(实验探究)
(一)探究BaCO3和BaSO4之间的转化,实验操作如下所示:
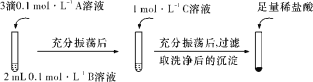
试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
实验Ⅰ | ||||
实验Ⅱ | BaCl2 | |||
Na2CO3 | Na2SO4 | …… | ||
Na2SO4 | 有少量气泡产生,沉淀部分溶解 |
(1)实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入稀盐酸后,__________。
(2)实验Ⅱ中加入稀盐酸后发生反应的离子方程式是_________。
(3)实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:___________。
(二)探究AgCl和AgI之间的转化。
(4)实验Ⅲ:证明AgCl转化为AgI。
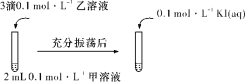
甲溶液可以是______(填字母代号)。
a AgNO3溶液 b NaCl溶液 c KI溶液
(5)实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
装置 | 步骤 | 电压表读数 |
| ||
ⅰ.按图连接装置并加入试剂,闭合K | a | |
ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | |
ⅲ.再向B中投入一定量NaCl(s) | c | |
ⅳ.重复ⅰ,再向B中加入与ⅲ等量的NaCl(s) | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①查阅有关资料可知,Ag+可氧化I-,但AgNO3溶液与KI溶液混合总是得到AgI沉淀,原因是氧化还原反应速率__________(填“大于”或“小于”)沉淀反应速率。设计(-)石墨(s)[I-(aq)//Ag+(aq)]石墨(s)(+)原电池(使用盐桥阻断Ag+与I-的相互接触)如上图所示,则该原电池总反应的离子方程式为________。
②结合信息,解释实验Ⅳ中b<a的原因:__________。
③实验Ⅳ的现象能说明AgI转化为
(实验结论)溶解度小的沉淀容易转化为溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化溶解度较大的沉淀越难实现。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的合成路线如下图所示:
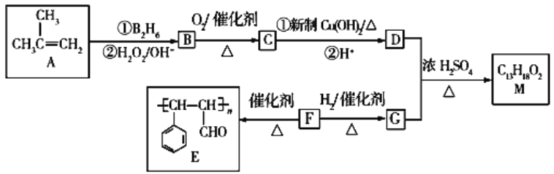
已知:R—CH=CH2![]() R—CH2CH2OH。
R—CH2CH2OH。
请回答下列问题:
(1)有机物B的系统命名为__________。
(2)F中所含官能团的名称为__________,F→G的反应类型为__________。
(3)M的结构简式为_________。
(4)B→C反应的化学方程式为__________。
(5)X是G的同系物,且相对分子质量比G小14,X有多种同分异构体,满足与FeCl3溶液反应显紫色的有______种。其中核磁共振氢谱显示有4种不同化学环境的氢,且峰面积比为1∶1∶2∶6的结构简式为______。
(6)参照M的合成路线,设计一条由丙烯和乙醇为起始原料制备丙酸乙酯的合成路线_________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实或实验现象的化学用语正确的是
A. 硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 + 4H+ ![]() 2I2+2H2O
2I2+2H2O
B. 铁和稀硝酸反应制得浅绿色溶液:Fe + 4H+ + NO3-![]() Fe3+ + NO↑+ 2H2O
Fe3+ + NO↑+ 2H2O
C. 水垢上滴入CH3COOH溶液有气泡产生:CaCO3+2H+ ![]() Ca2++CO2↑+ H2O
Ca2++CO2↑+ H2O
D. SO2通入漂白粉溶液中产生白色浑浊:SO2+Ca2++2ClO-+H2O ![]() CaSO3↓+2HClO
CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。

已知有机物的相关数据如下表所示:
有机物 | 沸点℃ | 密度为g/cm3 | 相对分子质量 | 溶解性 |
苯甲醛 | 178.1 | 1.04 | 106 | 微溶于水,易溶于乙醇、醚和卤代烃 |
苯甲醇 | 205.7 | 1.04 | 108 | 微溶于水,易溶于乙醇、醚和卤代烃 |
二氯甲烷 | 39.8 | 1.33 | 难溶于水,易溶于有机溶剂 |
实验步骤:
①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9-10后,加入3.0mL苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到2.08g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作, 可能造成的后果是______。
(4)步骤②中,应选用的实验装置是___(填序号),该操作中分离出有机相的具体操作方法是___。

(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素镍(Ni)、锰(Mn)及其化合物常用作工业生产的催化剂。已知Ni(OH)2(蓝绿色)、Mn(OH)2(紫色)均难溶于水,Ksp[Ni(OH)2]=6×1018,Ksp[Mn(OH)2]=2×1013,回答下列问题:
(1)某溶液中含有浓度较大的Ni2+和Mn2+,向其中滴加NaOH溶液,当Ni2+恰好沉淀完全(恰好完全沉淀时Ni2+浓度等于1.0×105mol·L1)时,溶液中的c(H+)=_______mol/L,此时溶液中c(Mn2+)=_______mol/L(提示:![]() )。
)。
(2)血红蛋白(Hb)与O2和CO存在如下平衡:Hb(aq)+O2(g)![]() HbO2(aq)K1,Hb(aq)+CO(g)
HbO2(aq)K1,Hb(aq)+CO(g)![]() HbCO(aq)K2,正常体温下血红蛋白与两种气体的结合度(α)(注:α
HbCO(aq)K2,正常体温下血红蛋白与两种气体的结合度(α)(注:α![]() =),随两气体平衡分压的变化关系如下图所示:
=),随两气体平衡分压的变化关系如下图所示:
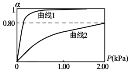
①若平衡常数K1远小于K2,则上图中曲线1代表的气体是_______;利用图中所给数据计算曲线2所代表平衡的平衡常数_______(用气体的平衡分压代替气体的平衡浓度)
②CO和Ni能发生反应生成四羰基镍:Ni+4CO![]() Ni(CO)4(四羰基镍),已知四羰基镍在温度高的条件下易分解,则该反应的正反应是_______(填“放热反应”或“吸热反应”),四羰基镍进入人体血液后更容易释放出金属镍,从而使人镍中毒,分析其中的原因_______。
Ni(CO)4(四羰基镍),已知四羰基镍在温度高的条件下易分解,则该反应的正反应是_______(填“放热反应”或“吸热反应”),四羰基镍进入人体血液后更容易释放出金属镍,从而使人镍中毒,分析其中的原因_______。
(3)已知Ni(OH)3难溶于水,它可由Ni(OH)2与NaClO溶液反应得到,试写出该反应的离子方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO-的浓度存在关系式c(HCOO-)+c(HCOOH)=0.100 mol/L,含碳元素的粒子的浓度与pH的关系如图所示。下列说法正确的是

A. 298K时,加蒸溜水稀释P点溶液,溶液中n(H+)·n(OH-)保持不变
B. 0.1 mol/L HCOONa溶液中有c(HCOO-)+c(OH-)=c(H+)+c(HCOOH)
C. 298K时,HCOOH的电离常数Ka=1.0×10-3.75
D. 0.1 mol/L HCOONa溶液和0.1 mol/L HCOOH溶液等体积混合后,溶液的pH=3.75(混合后溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是
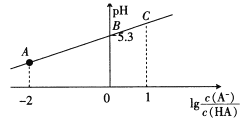
A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com