
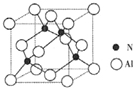
 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题: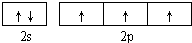 ,氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO
,氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO- 3 |
| O | + 2 |
| 5-1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
 ,氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO
,氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO- 3 |
| O | + 2 |
| 5-1 |
| 2 |
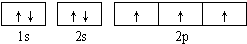 ;直线; sp;
;直线; sp;| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
| ||
| 晶胞边长3 |
| 3 |
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||


科目:高中化学 来源: 题型:
 发展混合动力车是实施节能减排的重要措施之一.混合动力车的电动机目前一般使用的是镍氢电池.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液.镍氢电池充放电原理如图,其总反应式为:H2+2NiOOH
发展混合动力车是实施节能减排的重要措施之一.混合动力车的电动机目前一般使用的是镍氢电池.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液.镍氢电池充放电原理如图,其总反应式为:H2+2NiOOH| 放电 |
| 充电 |
| A、在上坡或加速时,每消耗22.4LH2,从电极甲流向电极乙的电子是2mol |
| B、在上坡或加速时,乙电极周围溶液的pH将减小 |
| C、在刹车和下坡时,溶液中的K+向乙电极迁移 |
| D、在刹车和下坡时,甲电极的电极反应式为2H2O+2e-═H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P、S、Cl元素最高正化合价依次升高 |
| B、碱性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3 |
| C、S2-、Cl-、K+、Ca2+离子半径依次增大 |
| D、热稳定性:H2S>PH3>AsH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 猜想物质的化学式 | 检验所需要的试剂 | 操作、现象和结论 | |
| ① | |||
| ② |
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.今运动场馆大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED晶片,材质基本以GaAs(砷化镓)、InGaN(氮化铟镓)为主.砷化镓作为第三代半导体,以其为材料制造的灯泡寿命长.耗能少.
Ⅰ.今运动场馆大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED晶片,材质基本以GaAs(砷化镓)、InGaN(氮化铟镓)为主.砷化镓作为第三代半导体,以其为材料制造的灯泡寿命长.耗能少.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中有c(NH4+)=c(Cl-) | ||
| B、此时水的电离程度最大 | ||
C、此时溶液中氨水的物质的量浓度为
| ||
| D、a>0.01 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com