
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H=74.9 kJ·mol-1,下列说法中正确的是
A.该反应中熵变、焓变皆大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(2013?金华模拟)有A、B、C、D四种强电解质,它们在水中电离产生的离子如下表(每种物质只含一种阴离子且互不重复).
①A、C溶液的pH均大于7,A、B溶液中水的电离程度比纯水大; ②C溶液和D溶液混合时只产生白色沉淀,B溶液和C溶液混合时只产生刺激性气味的气体,A溶液和D溶液混合时无明显现象. 有关说法不正确的是( ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | AlOH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
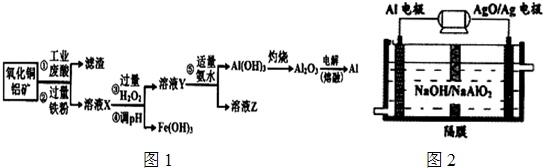
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com