
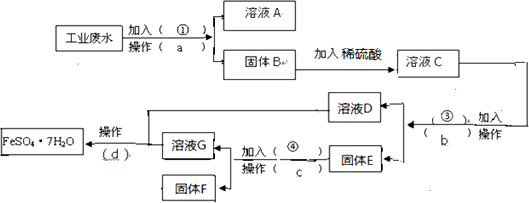


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
(1)废水I若采用CO2处理,离子方程式是 。
(2)废水II常用明矾处理。实验中发现废水中的c(HCO-3)越大,净水效果越好,这是因为 。
(3)废水III中的汞元素存在如下转化(在空格上填相应的化学式):
Hg2+ =====CH3Hg++H+
我国规定,Hg2+的排放标准不能超过0.05mg/L。某工厂排放的1m3废水中含Hg2+ 3×10-4mol,是否达到了排放标准 (填“是”或“否”)。
(4)废水IV常用Cl2将CN-氧化成两种无毒气体,则该反应的离子方程式为
.
查看答案和解析>>
科目:高中化学 来源:湖南省长郡中学2011届高三分班考试化学试题 题型:填空题
(10分)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。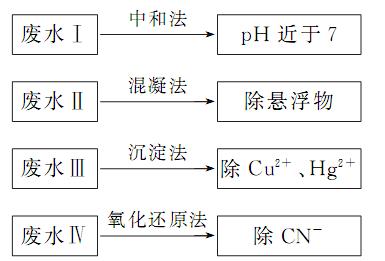
(1)废水I若采用CO2处理,离子方程式是 。
(2)废水II常用明矾处理。实验中发现废水中的c(HCO-3)越大,净水效果越好,这是因为 。
(3)废水III中的汞元素存在如下转化 (在空格上填相应的化学式):
(在空格上填相应的化学式):
Hg2+ =====CH3Hg++H+
我国规定,Hg2+的排放标准不能超过0.05mg/L。某工厂排放的1m3废水中含Hg2+ 3×10-4mol,是否达到了排放标准 (填“是”或“否”)。
(4)废水IV常用Cl2将CN-氧化成两种无毒气体,则该反应的离子方程式为
.
查看答案和解析>>
科目:高中化学 来源:湖南省2010-2011学年高三分班考试化学试题 题型:填空题
(10分)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。

(1)废水I若采用CO2处理,离子方程式是 。
(2)废水II常用明矾处理。实验中发现废水中的c(HCO-3)越大,净水效果越好,这是因为 。
(3)废水III中的汞元素存在如下转化(在空格上填相应的化学式):
Hg2+ =====CH3Hg++H+
我国规定,Hg2+的排放标准不能超过0.05mg/L。某工厂排放的1m3废水中含Hg2+ 3×10-4mol,是否达到了排放标准 (填“是”或“否”)。
(4)废水IV常用Cl2将CN-氧化成两种无毒气体,则该反应的离子方程式为
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com