
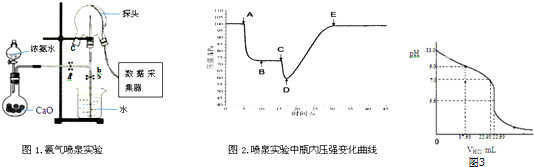
分析 (1)三颈瓶内气体与外界大气压压强之差越大,其喷泉越剧烈;
(2)根据氨气极易溶于水,尾气吸收时要防止倒吸,导气管不能插入到液面以下以及氨气难溶于有机溶剂CCl4;
(3)氨水的物质的量浓度=$\frac{1}{Vm}$mol/L=$\frac{1}{22.4}$mol/L;弱电解质电离平衡常数Kb=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O))}$;pH=11的氨水中c(OH-)=0.001mol/L,c(OH-)≈c(NH4+)=0.001mol/L,c(NH3•H2O)≈0.0450mol/L,当VHCI=17.50ml时,溶液PH=9,溶液显碱性,此时溶液中为氯化铵和一水合氨;
(4)A.锥形瓶中有少量蒸馏水不影响氨水的物质的量;
B.利用pH计判断滴定终点更准确;
C.酸式滴定管未用盐酸润洗会导致盐酸浓度偏低;
D.滴定终点时俯视读数会导致盐酸物质的量偏小.
解答 解:(1)三颈瓶内气体与外界大气压压强之差越大,其反应速率越快,D点压强最小、大气压不变,所以大气压和D点压强差最大,则喷泉越剧烈,故答案为:D;
(2)从三颈瓶中量取25.00mL氨水至锥形瓶中,加入甲基橙指示剂,在碱溶液中是黄色,PH变色范围为:3.1-4.4,用0.0500mol•L-1HCl滴定.终点时溶液颜色由黄色变化为橙色,
故答案为:甲基橙;黄;橙;
(3)氨水的物质的量浓度=$\frac{1}{Vm}$mol/L=$\frac{1}{22.4}$mol/L;弱电解质电离平衡常数Kb=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O))}$;pH=11的氨水中c(OH-)=0.001mol/L,c(OH-)≈c(NH4+)=0.001mol/L,c(NH3•H2O)≈0.0450mol/L,当VHCI=17.50ml时,溶液PH=9,溶液显碱性,此时溶液中为氯化铵和一水合氨,一水合氨电离大于铵根离子水解程度,所以溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:0.0450;c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(4)c(待测)=$\frac{c标准×V标准}{V待测}$,标准溶液浓度和待测溶液体积是恒定数值,分析操作归结为标准溶液的体积变化来判断待测溶液的浓度变化,
A.锥形瓶中有少量蒸馏水,待测溶液浓度稀释,溶质物质的量不变,对测定结果无影响,故A错误;
B.酸式滴定管在滴定前有气泡,滴定后气泡消失,消耗标准溶液盐酸的体积增大,测得氨水的浓度偏高,故B正确;
C.酸式滴定管未用盐酸润洗会导致标准溶液浓度减小,测得氨水的浓度偏高,故C正确;
D.滴定终点时俯视读数,读取标准溶液的体积会偏小,导致测得氨水的浓度偏低,故D正确;
故答案为:BCD.
点评 本题考查性质实验方案设计,侧重考查学生分析、判断及实验操作能力,明确滴定原理、喷泉实验原理、弱电解质电离等知识点是解本题关键,中和滴定的步骤和误差分析方法,题目难度中等.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强/MPa 体积分数/% 温度/℃ | 2.0 | 4.0 | 6.0 |
| 700 | 55.0 | a | b |
| 850 | c | 75.0 | d |
| 950 | e | f | 85.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com