
【题目】下列描述正确的是
A. 氯气、活性炭都能使品红溶液褪色,它们的漂白原理相同
B. 氢氧化铁胶体粒子在电场的影响下将向阴极移动,说明氢氧化铁胶体带正电。
C. 向某溶液中加入NaOH溶液后再滴加红色石蕊试液变蓝说明溶液中含有NH4+
D. 已知298K时,合成氨反应N2(g) +3H2(g)![]() 2NH3(g) △H=-92.0kJ/mol ,在密闭容器中加入一定量反应物达平衡后生成0.2mol NH3,测得反应放出的热量为9.20kJ
2NH3(g) △H=-92.0kJ/mol ,在密闭容器中加入一定量反应物达平衡后生成0.2mol NH3,测得反应放出的热量为9.20kJ
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】NH3是重要的化工原料。某实验室对氨气进行下列研究。
(1)相同温度下,在三个体积均为2.0L的恒容密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),反应过程中测定的部分数据见下表:
2NH3(g),反应过程中测定的部分数据见下表:
容器编号 | 起始各物质的物质的量/mol | 平衡物质的量(mol) | 平衡压强(Pa) | ||
N2(g) | H2(g) | NH3(g) | NH3(g) | ||
Ⅰ | 4 | 12 | 0 | 4 | P1 |
Ⅱ | 2 | 6 | 0 | C2 | P2 |
Ⅲ | 1.5 | 4.0 | 3 | ? | ? |
①若容器Ⅰ中反应50秒到达平衡,则该时段v(H2)= mol/(L·s)
②容器Ⅰ、Ⅱ中反应均到达平衡时c2 2;p1 2p2(填“>”、“<”或“=”)
③容器Ⅲ中,达到平衡前v(正) v(逆) (填“>”、“<”或“=”)
(2)①已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g)=2NO(g) △H=180.5 kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ/mol
则4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H= KJ/mol
4NO(g)+6H2O(g);△H= KJ/mol
②将4molNH3和5molO2分别置于5个体积相同、温度不同的容器中在铂系催化剂作用下进行反应,相同时间后测量5个容器中N产率如图所示。下列说法正确的是 (填字母)。
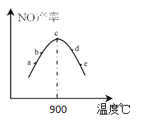
A.a点v(正)大于v(逆)
B.c点反应速率最快
C.温度高于900℃时,NO产率下降的原因是因为温度升高导致平衡逆向移动
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)。则该燃料电池的负极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料。
(1)工业上主要用TiO2氯化的方法来制取TiCl4
① 有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)![]() TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
TiCl4(l)+O2(g) ,写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 。
② 工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因 。
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置图如下:
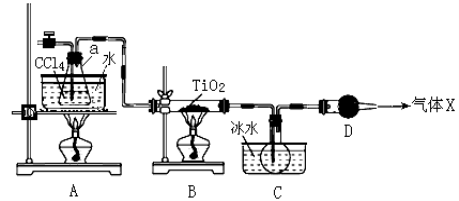
下表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
① 实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 。
② 本实验中仪器a采用题给的加热方式的突出优点是 。
③ B中CCl4与TiO2发生反应的化学方程式是 。
④ 欲分离C装置中的TiCl4,应采用的实验操作为 (填操作名称)。
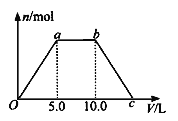
⑤ 若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是
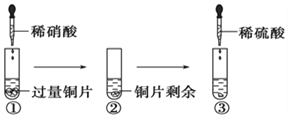
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.向CuSO4溶液中投入Na:Cu2++2Na=Cu+2Na+
B.向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-=Fe(SCN)3↓
C.向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
D.向BaCl2溶液中通入SO2气体:SO2+H2O+Ba2+=BaSO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中含有NA个氯化氢分子的是
A. 将lmol H2和1molCl2光照或点燃后的产物
B. 6.02×1023个HCl气体分子
C. 室温下,将1molHCl气体通入100mL水中所得溶液
D. 室温下,73gHCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中生成物总能量高于反应物总能量的是
A.氢氧化钠溶液与稀硫酸混合 B.异丁醇燃烧
C.氢氧化钡晶体与氯化铵晶体混合搅拌 D.氧化钙溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积固定为2L的密闭容器中充入9.6mol NO和4.8molO2,发生如下反应:
①2NO(g)+O2(g)![]() 2NO2(g) △H<0
2NO2(g) △H<0
②2NO2(g)![]() N2O4(g) △H<0
N2O4(g) △H<0
测得反应达到平衡时NO2浓度为1.2 mol/L,N2O4的浓度为0.8 mol/L。则反应①的化学平衡常数为( )
A. 0.24 B.0.36 C.1.44 D.l.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.H2(g)+Br2(g)=2HBr(g) ΔH=-72 kJ·mol-1其他相关数据如下表:

则表中a为230
B.已知:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol-1
所以![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l)ΔH=-57.3kJ·mol-1
BaSO4(s)+H2O(l)ΔH=-57.3kJ·mol-1
C.已知CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-802.33kJ·mol-1,则CH4的燃烧热为802.33kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g)ΔH1,2C(s)+O2(g)=2CO(g)ΔH2,则ΔH1>ΔH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com