
°æƒø°ø¬±◊‘™Àÿ‘⁄ªØ—ß÷–”–◊≈º´Œ™π„∑∫µƒ”¶”√°£
¢Ò. ”…”⁄∑˙µƒÃÿ ‚ªØ—ß–‘÷ £¨À¸∫Õ∆‰À˚¬±Àÿ‘⁄µ•÷ º∞ªØ∫œŒÔµƒ÷∆±∏”Ζ‘÷ …œ¥Ê‘⁄Ωœ√˜œ‘µƒ≤Ó“Ï°£
£®1£©ªØ—ߺ“—–æø∑¢œ÷£¨SbF5ƒÐ”Î[MnF6]2£≠¿Î◊”∑¥”¶µ√µΩMnF4£¨SbF5◊™ªØ≥…Œ»∂®¿Î◊”[SbF6]£≠µƒ—Œ°£∂¯MnF4∫Ð≤ªŒ»∂®£¨ л»“◊∑÷Ω‚Œ™MnF3∫ÕF2°£∏˘æð“‘…œ—–æø–¥≥ˆ“‘K2MnF6∫ÕSbF5Œ™‘≠¡œ£¨‘⁄423 K µƒŒ¬∂»œ¬÷∆±∏F2µƒªØ—ß∑Ω≥Ã Ω£∫________________________________________________°£
£®2£©œ÷¥˙𧓵“‘µÁΩ‚»€»⁄µƒ∑˙«‚ªØºÿ(KHF2)∫Õ∑˙ªØ«‚(HF)ªÏ∫œŒÔ÷∆±∏∑˙µ•÷ £¨µÁΩ‚÷∆∑˙◊∞÷√»ÁÕºÀ˘ æ°£

µÁΩ‚÷∆∑˙ ±£¨“™”√ƒ¯Õ≠∫œΩ∏Ù∞ÂΩ´¡Ω÷÷∆¯ÃÂ≤˙ŒÔ—œ∏Ò∑÷ø™µƒ‘≠“Ú «______________________°£
£®3£©HFµƒÀƻГ∫ ««‚∑˙À·£¨ƒÐ”√”⁄ ¥øÃ≤£¡ß£¨∆‰ªØ—ß∑¥”¶∑Ω≥Ã ΩŒ™£∫ ____________________°£
¢Ú. µ—È “≥£”√∏þ√ÃÀ·ºÿπÃÔÎ≈®—ŒÀ·∑¥”¶÷∆±∏¬»∆¯°£Ω´0.08mol KMnO4πÃú”»»“ª∂Œ ±º‰∫Û£¨ ’ºØµΩa molO2£ªœÚ∑¥”¶∫Û≤–¡ÙµƒπÃÃÂ÷–º”»Î◊„¡øµƒ≈®—ŒÀ·£¨”÷ ’ºØµΩb mol Cl2£¨¥À ±Mn‘™Àÿ»´≤ø“‘Mn2+µƒ–Œ Ω¥Ê‘⁄”⁄»Ð“∫÷–°£
£®1£©«Î∏˘æð…œ ˆ√Ë ˆ–¥≥ˆK2MnO4”Î≈®—ŒÀ·∑¥”¶÷∆¬»∆¯µƒ¿Î◊”∑¥”¶∑Ω≥Ã Ω£∫__________________°£
£®2£©Õ®π˝…œ ˆŒƒ◊÷÷–Ã·π©µƒ ˝æðº∆À„≥ˆa+bµƒ∑∂ŒßŒ™_____________________°£
¢Û. ClO2ø…ÃÊ¥˙Cl2◊˜Œ™◊‘¿¥ÀÆœ˚∂溡°£≥£”√ °∞”––߬»∫¨¡ø°±ø…”√¿¥∫‚¡ø∫¨¬»œ˚∂溡µƒœ˚∂æƒÐ¡¶£¨∆‰∂®“ «£∫√øøÀ∫¨¬»œ˚∂溡µƒ—ıªØƒÐ¡¶œýµ±”⁄∂ý…ŸøÀCl2µƒ—ıªØƒÐ¡¶°£‘ÚClO2µƒ”––߬»∫¨¡øŒ™__________°£(º∆À„Ω·π˚±£¡Ù¡ΩŒª–° ˝)
°æ¥∞∏°ø 2K2MnF6£´4SbF5![]() 4KSbF6£´2MnF3£´F2°¸ ∑˙∆¯∫Õ«‚∆¯ƒÐ∑¢…˙æÁ¡“∑¥”¶£¨“˝∑¢±¨’® SiO2£´4HF===SiF4°¸£´2H2O MnO42-£´8H++4Cl-=Mn2+£´2Cl2°¸£´4H2O 0.16°Ða+b£º0.2 2.63
4KSbF6£´2MnF3£´F2°¸ ∑˙∆¯∫Õ«‚∆¯ƒÐ∑¢…˙æÁ¡“∑¥”¶£¨“˝∑¢±¨’® SiO2£´4HF===SiF4°¸£´2H2O MnO42-£´8H++4Cl-=Mn2+£´2Cl2°¸£´4H2O 0.16°Ða+b£º0.2 2.63
°æΩ‚Œˆ°ø ‘Â∑÷Œˆ£∫±æÂ÷˜“™øº≤Ȫؗß∑Ω≥à Ω∫Õ¿Î◊”∑Ω≥Ã Ωµƒ È–¥£¨—ıªØªπ‘≠∑¥”¶µƒº∆À„°£
I£®1£©∏˘æð“‚–¥≥ˆ£∫K2MnF6+2SbF5=2KSbF6+MnF4£¨2MnF4![]() 2MnF3+F2°¸£¨¡Ω Ωœýº”œ˚»•≤ªŒ»∂®µƒMnF4£¨‘⁄423Kœ¬÷∆±∏F2µƒªØ—ß∑Ω≥Ã ΩŒ™2K2MnF6£´4SbF5
2MnF3+F2°¸£¨¡Ω Ωœýº”œ˚»•≤ªŒ»∂®µƒMnF4£¨‘⁄423Kœ¬÷∆±∏F2µƒªØ—ß∑Ω≥Ã ΩŒ™2K2MnF6£´4SbF5![]() 4KSbF6£´2MnF3£´F2°¸°£
4KSbF6£´2MnF3£´F2°¸°£
£®2£©«‚∆¯”Î∑˙∆¯ƒÐ∑¢…˙æÁ¡“∑¥”¶£¨∑¢…˙±¨’®£¨À˘“‘µÁΩ‚÷∆∑˙ ±£¨“™”√ƒ¯Õ≠∫œΩ∏Ù∞ÂΩ´¡Ω÷÷∆¯ÃÂ≤˙ŒÔ—œ∏Ò∑÷ø™°£
£®3£©≤£¡ßµƒ÷˜“™≥…∑÷Œ™SiO2£¨SiO2”ÎHF∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™£∫SiO2+4HF=SiF4°¸+2H2O°£
II£®1£©KMnO4 л»∑÷Ω‚…˙≥…K2MnO4°¢MnO2∫ÕO2£¨∏˘æð“‚K2MnO4”Î≈®—ŒÀ·∑¥”¶≤˙…˙Cl2£¨K2MnO4±ªªπ‘≠≥…Mn2+£¨∑¥”¶ø…–¥≥…£∫MnO42-+Cl-+H+°˙Mn2++Cl2°¸+H2O£¨Mn‘™ÀÿµƒªØ∫œº€”…+6º€Ωµ÷¡+2º€£¨Cl‘™ÀÿµƒªØ∫œº€”…-1º€…˝÷¡0º€£¨∏˘æðµ√ ßµÁ◊” ÿ∫„≈‰∆Ω£¨MnO42-+4Cl-+H+°˙Mn2++2Cl2°¸+H2O£¨Ω·∫œ‘≠◊” ÿ∫„∫ÕµÁ∫… ÿ∫„£¨–¥≥ˆ¿Î◊”∑Ω≥Ã ΩŒ™£∫MnO42-+4Cl-+8H+=Mn2++2Cl2°¸+4H2O°£
£®2£©‘⁄’˚∏ˆπ˝≥Ã÷–KMnO4÷–À˘”–Mn‘™ÀÿµƒªØ∫œº€∂º”…+7º€ΩµŒ™+2º€£¨∑÷Ω‚π˝≥Ã÷–µƒ—ıªØ≤˙ŒÔŒ™O2£¨”Î≈®—ŒÀ·∑¥”¶µƒ—ıªØ≤˙ŒÔŒ™Cl2£¨∏˘æðµ√ ßµÁ◊” ÿ∫„£¨0.08mol![]() 5=4n£®O2£©+2n£®Cl2£©£¨4a+2b=0.4°£»ÙKMnO4√ª”–∑÷Ω‚£¨a=0£¨b=0.2£¨a+b=0.2£ª»ÙKMnO4ÕÍ»´∑÷Ω‚£¨∏˘æð∑Ω≥Ã Ω£∫2KMnO4
5=4n£®O2£©+2n£®Cl2£©£¨4a+2b=0.4°£»ÙKMnO4√ª”–∑÷Ω‚£¨a=0£¨b=0.2£¨a+b=0.2£ª»ÙKMnO4ÕÍ»´∑÷Ω‚£¨∏˘æð∑Ω≥Ã Ω£∫2KMnO4![]() K2MnO4+MnO2+O2°¸£¨a»°◊Ó¥Û÷µ0.04£¨‘Úb=0.12£¨a+b=0.16£¨a+bµƒ»°÷µ∑∂ŒßŒ™£∫0.16
K2MnO4+MnO2+O2°¸£¨a»°◊Ó¥Û÷µ0.04£¨‘Úb=0.12£¨a+b=0.16£¨a+bµƒ»°÷µ∑∂ŒßŒ™£∫0.16![]() a+b
a+b![]() 0.2°£
0.2°£
III.ClO2![]() Cl-£¨1gClO2µ√µΩµÁ◊”ŒÔ÷ µƒ¡øŒ™
Cl-£¨1gClO2µ√µΩµÁ◊”ŒÔ÷ µƒ¡øŒ™![]() 5£¨∏˘æð°∞”––߬»∫¨¡ø°±µƒ∂®“£¨m£®Cl2£©
5£¨∏˘æð°∞”––߬»∫¨¡ø°±µƒ∂®“£¨m£®Cl2£©![]() 71g/mol
71g/mol![]() 2=
2=![]() 5£¨m£®Cl2£©=2.63g£¨‘ÚClO2µƒ”––߬»∫¨¡øŒ™2.63°£
5£¨m£®Cl2£©=2.63g£¨‘ÚClO2µƒ”––߬»∫¨¡øŒ™2.63°£



| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø»ÁÕº «≥£º˚Àƒ÷÷”–ª˙ŒÔµƒ±»¿˝ƒ£–Õ æ“‚Õº£Æœ¬¡–Àµ∑®’˝»∑µƒ «£® £©
A.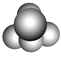
º◊ƒÐ πÀ·–‘∏þ√ÃÀ·ºÿ»Ð“∫Õ …´
B.![]()
““ø…”ΉÂÀÆ∑¢…˙º”≥…∑¥”¶ π‰ÂÀÆÕ …´
C.![]()
±˚÷–µƒÃºÃºº¸ «ÃºÃºµ•º¸∫ÕúúÀ´º¸ΩªÃÊΩ·∫œ
D.![]()
∂°‘⁄Cu¥þªØ◊˜”√œ¬ø…”Ηı∆¯∑¢…˙»°¥˙∑¥”¶
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø”√∂Ë–‘µÁº´µÁΩ‚“ª∂®≈®∂»µƒCuSO4»Ð“∫£¨Õ®µÁ“ª∂Œ ±º‰∫Û£¨œÚÀ˘µ√µƒ»Ð“∫÷–º”»Î0.1molCu£®OH£©2∫Û«°∫√ª÷∏¥µΩµÁΩ‚«∞µƒ≈®∂»∫ÕpH£Æ‘Úœ¬¡–Àµ∑®’˝»∑µƒ «£® £©
A.µÁΩ‚π˝≥Ã÷–“ıº´√ª”–∆¯ÃÂ…˙≥…
B.µÁΩ‚π˝≥Ã÷–◊™“∆µƒµÁ◊”µƒŒÔ÷ µƒ¡øŒ™0.4 mol
C.‘≠CuSO4»Ð“∫µƒ≈®∂»Œ™0.1 molL©Å1
D.µÁΩ‚π˝≥Ã÷–—Ùº´ ’ºØµΩµƒ∆¯ÃÂê˝Œ™1.12 L£®±Íøˆœ¬£©
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø”√œ¬¡– µ—È◊∞÷√ÕÍ≥…∂‘”¶µƒ µ—È£¨≤ªƒÐ¥ÔµΩ µ—ȃøµƒµƒ”–_____∏ˆ
1 | 2 | 3 | 4 |
|
|
|
|
÷∆»°≤¢ ’ºØ…Ÿ¡ø∞±∆¯ | ¥”±•∫Õ ≥—ŒÀÆ÷–÷»°NaClæßà| —È÷§NaHCO3∫ÕNa2CO3µƒ»»Œ»∂®–‘ | ≤…”√CCl4ðÕ»°I2 |
A. 1∏ˆ B. 2∏ˆ C. 3∏ˆ D. 4∏ˆ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øúº∞∆‰ªØ∫œŒÔ‘⁄ƒÐ‘¥∫Õ≤ƒ¡œ∑Ω√Êæþ”–π„∑∫µƒ”√Õ棨ªÿ¥œ¬¡–Œ £∫
£®1£©“—÷™CH4(g)+ ![]() O2(g)=CO(g)+2H2O(l)
O2(g)=CO(g)+2H2O(l) ![]() =-607.31kJ/mol
=-607.31kJ/mol
2CO(g)+ O2(g)=2CO2(g) ![]() =-566.0kJ/mol
=-566.0kJ/mol
–¥≥ˆ±Ì æº◊ÕÈ»º…’»»µƒ»»ªØ—ß∑Ω≥à Ω____________°£
£®2£©ÃÏ»ª∆¯µƒ“ª∏ˆ÷ÿ“™”√Õæ «÷∆»°H2£¨∆‰‘≠¿ÌŒ™£∫CO2(g)£´CH4(g) ![]() 2CO(g)£´2H2(g) °£‘⁄√б’»ð∆˜÷–Õ®»ÎŒÔ÷ µƒ¡ø≈®∂»æ˘Œ™0.125mol/LµƒCH4”ÎCO2£¨‘⁄“ª∂®Ãıº˛œ¬∑¢…˙∑¥”¶£¨≤‚µ√CH4µƒ∆Ω∫‚◊™ªØ¬ ”ÎŒ¬∂»º∞—π«øµƒπÿœµ»Áœ¬ÕºÀ˘ æ°£‘Ú£∫
2CO(g)£´2H2(g) °£‘⁄√б’»ð∆˜÷–Õ®»ÎŒÔ÷ µƒ¡ø≈®∂»æ˘Œ™0.125mol/LµƒCH4”ÎCO2£¨‘⁄“ª∂®Ãıº˛œ¬∑¢…˙∑¥”¶£¨≤‚µ√CH4µƒ∆Ω∫‚◊™ªØ¬ ”ÎŒ¬∂»º∞—π«øµƒπÿœµ»Áœ¬ÕºÀ˘ æ°£‘Ú£∫

¢Ÿ—π«øP1_____P2£®ÃÓ °∞>°±ªÚ°∞<°±£©£ª
¢⁄—π«øŒ™P2 ±£¨‘⁄Yµ„£∫v(’˝)_______v(ƒÊ)£®ÃÓ°∞>°±°¢°∞<°±ªÚ°∞=°±£©°£
¢€«ÛYµ„∂‘”¶Œ¬∂»œ¬µƒ∏√∑¥”¶µƒ∆Ω∫‚≥£ ˝K=_________°££®º∆À„Ω·π˚±£¡Ù¡ΩŒª–° ˝£©
£®3£©COø…“‘∫œ≥…∂˛º◊√—£¨2CO(g)+4H2(g)![]() CH3OCH3(g)£´H2O(g) °˜H<0£¨∂˛º◊√—ø…“‘◊˜Œ™»º¡œµÁ≥ÿµƒ‘≠¡œ°£
CH3OCH3(g)£´H2O(g) °˜H<0£¨∂˛º◊√—ø…“‘◊˜Œ™»º¡œµÁ≥ÿµƒ‘≠¡œ°£
¢Ÿ–¥≥ˆ∂˛º◊√—‘⁄KOH◊ˆµÁΩ‚÷ Ãıº˛œ¬µƒ∏∫º´µÁº´∑¥”¶ Ω_____________________°£
¢⁄¿˚”√¥À»º¡œµÁ≥ÿ“‘ ؃´Œ™µÁº´µÁΩ‚1L£¨0.5mol/LµƒCuSO4»Ð“∫£¨µºœþÕ®π˝1molµÁ◊” ±£¨ºŸ…˻Г∫ê˝≤ª±‰£¨‘ÚÀ˘µ√»Ð“∫pH=_________£¨¿Ì¬€…œœ˚∫ƒ∂˛º◊√—________g£®±£¡Ù–° ˝µ„∫Û¡ΩŒª£©°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø“—÷™£∫N2£®g£©+3H2£®g£©![]() 2NH3£®l£©°˜H=©Å132kJ/mol£¨’Ù∑¢1mol NH3£®l£©–Ë“™Œ¸ ’µƒƒÐ¡øŒ™20kJ£¨œýπÿ ˝æð»Áœ¬
2NH3£®l£©°˜H=©Å132kJ/mol£¨’Ù∑¢1mol NH3£®l£©–Ë“™Œ¸ ’µƒƒÐ¡øŒ™20kJ£¨œýπÿ ˝æð»Áœ¬
H2£®g£© | N2£®g£© | NH3£®g£© | |
1mol∑÷◊”÷–µƒªØ—ߺ¸–Œ≥… ±“™ Õ∑≈≥ˆµƒƒÐ¡ø/kJ | 436 | 946 | a |
“ª∂®Ãıº˛œ¬£¨‘⁄ê˝1Lµƒ√б’»ð∆˜÷–º”»Î1molN2£®g£©∫Õ3molH2£®g£©≥‰∑÷∑¥”¶£¨…˙≥…NH3£®g£©∑≈≥ˆ»»¡øQkJ£¨œ¬¡–Àµ∑®’˝»∑µƒ «

A£Æ…œÕºø…±Ì æ∫œ≥…∞±π˝≥Ã÷–µƒƒÐ¡ø±‰ªØ
B£Æaµƒ ˝÷µŒ™1173
C£ÆQµƒ ˝÷µŒ™92
D£Æ∆‰À¸Ãıº˛œýÕ¨£¨∑¥”¶ π”√¥þªØº¡ ± Õ∑≈≥ˆµƒƒÐ¡ø¥Û”⁄ŒÞ¥þªØº¡ ± Õ∑≈≥ˆµƒƒÐ¡ø
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø÷ª”√“ª÷÷ ‘º¡æÕø…Ω´AgNO3°¢KSCN°¢H2SO4°¢NaOHÀƒ÷÷ŒÞ…´»Ð“∫«¯∑÷£¨’‚÷÷ ‘º¡ «( )
A. Fe(NO3)3»Ð“∫ B. MgCl2»Ð“∫
C. BaCl2»Ð“∫ D. FeCl3»Ð“∫
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–ªØ—ß”√”Ա̥Ԓ˝»∑µƒ «£® £©
A.HFµƒµÁ◊” ΩŒ™£∫ ![]()
B.HClOµƒΩ·ππ Ω£∫H©ÅCl©ÅO
C.÷ ◊” ˝Œ™92°¢÷–◊” ˝Œ™146µƒU‘≠◊”£∫ ![]() U
U
D.Cl©ÅµƒΩ·ππ æ“‚Õº£∫ 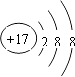
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øæð◊ÓΩ¸µƒ√¿π˙°∂≈©“µ—–æø°∑‘”÷æ±®µ¿£¨√¿π˙µƒø∆—ߺ“∑¢œ÷∞ÎÎ◊∞±À·ƒÐ‘ˆ«ø∞¨◊Ã≤°∏–»æ’þµƒ√‚“þ¡¶£¨∂‘øÿ÷∆∞¨◊Ã≤°≤°∂浃¬˚—””–∆Ê–ß°£“—÷™∞ÎÎ◊∞±À·µƒΩ·ππºÚ ΩŒ™£∫
‘Úœ¬¡–Àµ∑®¥ÌŒÛµƒ « (°°°°)°£
A. ∞ÎÎ◊∞±À· Ù”⁄∞±ª˘À·
B. ∞ÎÎ◊∞±À· «“ª÷÷¡Ω–‘ŒÔ÷
C. ¡Ω∑÷◊”∞ÎÎ◊∞±À·Õ—ÀÆ–Œ≥…µƒ∂˛ÎƒΩ·ππºÚ ΩŒ™![]()
D. HS°™CH2°™CH2°™COONH4ø…”ÎNaOH»Ð“∫∑¥”¶∑≈≥ˆ“ª÷÷ºÓ–‘∆¯ÃÂ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
∞Ÿ∂»÷¬–≈ - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com