
【题目】丙酸异丁酯(isobutyl acetate)具有菠萝香气,主要用作漆类的溶剂和配制香精。实验室制备丙酸异丁酯的反应、装置示意图和有关信息如下:


实验步骤:
在圆底烧瓶中加入3.7g的异丁醇,7.4 g的丙酸、数滴浓硫酸和2~3片碎瓷片,控温106~125℃,反应一段时间后停止加热和搅拌,反应液冷却至室温后,用饱和NaHCO3溶液洗涤分液后加入少量无水硫酸镁固体干燥,静置片刻,过滤除去硫酸镁固体,进行常压蒸馏纯化,收集130~136℃馏分,得丙酸异丁酯3.9 g。
回答下列问题:
(l)装置A的名称是__________。
(2)实验中的硫酸的主要作用是___________。
(3)用过量丙酸的主要目的是______________________。
(4)用饱和NaHCO3溶液洗涤粗酯的目的是____________。
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后_________(填字母)。
A.直接将丙酸异丁酯从分液漏斗上口倒出
B.直接将丙酸异丁酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将丙酸异丁酯从上口倒出
D.先将水层从分液漏斗的下口放出,再将丙酸异丁酯从下口放出
(6)本实验丙酸异丁酯的产率是_________。
【答案】 (球形)冷凝管 催化剂和吸水剂 增大反应物丙酸的浓度,有利于反应向生成丙酸异丁酯的方向进行 洗掉浓硫酸和丙酸 C 60%
【解析】丙酸异丁酯的制备类似于乙酸乙酯的制备,可以联系课本知识分析解答。(3)根据平衡移动的原理分析解答;(4)根据饱和碳酸氢钠溶液的作用分析解答;(6)根据产率=![]() ×100%进行计算。
×100%进行计算。
(l)根据图示,装置A是冷凝管,故答案为:冷凝管;
(2)根据酯化反应的原理可知,实验中的硫酸的主要作用是催化剂和吸水剂,故答案为:催化剂和吸水剂;
(3)用过量丙酸,能够增大反应物丙酸的浓度,有利于反应向生成丙酸异丁酯的方向进行,故答案为:增大反应物丙酸的浓度,有利于反应向生成丙酸异丁酯的方向进行;
(4)用饱和NaHCO3溶液洗涤粗酯,可以降低丙酸异丁酯在水中的溶解度,同时洗掉浓硫酸和丙酸,故答案为:洗掉浓硫酸和丙酸;
(5) 丙酸异丁酯的密度小于水,在洗涤、分液操作中,应充分振荡,然后静置,待分层后先将水层从分液漏斗的下口放出,再将丙酸异丁酯从上口倒出,故选C;
(6)7.4 g的丙酸的物质的量为![]() =0.1mol,3.7g的异丁醇的物质的量为
=0.1mol,3.7g的异丁醇的物质的量为![]() =0.05mol,理论上可以生成0.05mol丙酸异丁酯,质量为130g/mol×0.05mol=6.5g,而实际产量是3.9g,所以本次实验的产率=
=0.05mol,理论上可以生成0.05mol丙酸异丁酯,质量为130g/mol×0.05mol=6.5g,而实际产量是3.9g,所以本次实验的产率=![]() ×100%=60%,故答案为:60%。
×100%=60%,故答案为:60%。


科目:高中化学 来源: 题型:
【题目】下图是中学教材中元素周期表的一部分,其中标出A~R 15种元素,试根据它们回答下列问题(填具体元素符号或化学式):
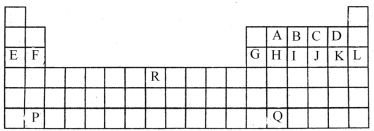
(1)化学性质最不活泼的是____,原子半径最小的是(除稀有气体元素)___属于过渡元素的是____(填A~R中的代号)。
(2)最高价氧化物对应的水化物中酸性最强的是_____,单质中氧化性最强的是________,第三周期元素形成的简单离子中半径最小的是______。
(3)F与K形成的化合物溶于水发生电离,所破坏的化学键为______。
(4)Q在元素周期表中的位置是_____,B、C可形成化合物B2C,该化合物的核外电子总数为_____。
(5)P的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物的离子方程式:____________。
(6)元素E与元素F相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.与酸反应时,每个F原子比每个E原子失电子数多
b.E的氢化物比F的氢化物稳定
c.E和F的单质与水反应E较剧烈
d.最高价氧化物对应水化物碱性E比F强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是
A. 浓硝酸保存在棕色试剂瓶中并放置在阴凉处
B. 少量的金属钠保存在煤油中
C. 液溴应保存在棕色细口瓶中,并加水液封
D. 新制的氯水通常保存在无色细口瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某太阳能电池的工作原理如图所示。下列说法正确的是( )

A. 硅太阳能电池供电原理与该电池相同
B. 光照时, H+由a极区经质子交换膜向b极区迁移
C. 光照时,b极的电极反应式为 VO2+-e-+H2O=VO2++2H+
D. 夜间无光照时,a极的电极反应式为V3++e-=V2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、 X 是4种中学化学中常见的物质,其转化关系符合下图(部分产物已略去)。下列说法中,正确的是
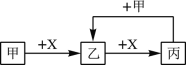
A. 若甲为单质铁,则丙一定为FeCl3
B. 若甲为强碱,则X一定为CO2
C. 若乙是一种白色胶状沉淀,则甲溶液中一定含有Al3+
D. 若甲为单质,则此关系中涉及的反应一定都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是( )
A. Na+(g)+Cl-(g) NaCl(s); △H1 B. Na(s)+![]() Cl2(g) NaCl(s); △H2
Cl2(g) NaCl(s); △H2
C. Na+(l)+Cl-(l) NaCl(s); △H3 D. Na(g)+ ![]() Cl2(g) NaCl(s); △H4
Cl2(g) NaCl(s); △H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图。已知该分子中N-N-N 键角都是108.1°,下列有关 N(NO2)3 的说法不正确的是( )

A. 该分子中既含有非极性键又含有极性键
B. 分子中四个氮原子不共平面
C. 该物质既有氧化性又有还原性
D. 15.2g 该物质含有6.02×1022个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的正极反应式为________________________。
(2)已知草酸分解的化学方程式为:H2C2O4![]() CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是________________。
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是________________。
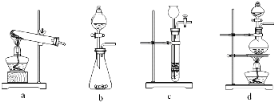
(3)某实验小组利用草酸分解产生的CO和铁锈反应来测定铁锈样品的组成(假定铁锈中只有Fe2O3· nH2O和Fe两种成份),实验装置如下图所示。

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是_______、________(填答案编号)。
a. 浓硫酸 b.澄清的石灰水 c. 氢氧化钠溶液 d. 无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)____________。
③E装置的作用是___________________________________________________________ 。
④准确称量样品10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =_____________。
⑤在本实验中,下列情况会使测定结果n偏大的是__________(填答案编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3·nH2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是( )
CH3COOH+OH-,下列说法正确的是( )
A. 加入少量固体FeCl3, c(CH3COO-)增大
B. 加入少量NaOH固体,c(CH3COO-)增大
C. 稀释溶液,溶液的pH增大
D. 加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com