
【题目】下列有关丙烯(CH3CH=CH2)的结构或性质叙述中不正确的是
A. 分子中所有碳原子都在同一平面上
B. 能使溴水褪色
C. 能使酸性高锰酸钾溶液褪色
D. 与氯化氢发生加成反应只能生成一种产物
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.反应条件是加热的反应都是吸热反应
B.化学反应除了生成新的物质外,还伴随着能量的变化
C.物质燃烧不一定是放热反应
D.放热的化学反应不需要加热就能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为________。
(2)同温同压下,氨气和硫化氢气体的密度比为________。
(3)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(4)在标准状况下,14 g CO与2 g H2的混合气体体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,它与我们的生活密切相关。自来水厂常用高铁酸钠(Na2FeO4)改善水质。高铁酸钠具有很强的氧化性,是一种新型的绿色净水消毒剂,在工业上制备高铁酸钠的方法有多种。
(1)简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理_________________________________________________________________________。
(2)干法制备高铁酸钠的反应原理如下:
2FeSO4+6Na2O2==aNa2FeO4+bM↑+2Na2O+2Na2SO4
①高铁酸钠中铁元素的化合价为________________。
②上述方程式中b=____。每生成1molM,该反应转移电子的物质的量为_____________mol。
(3)工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
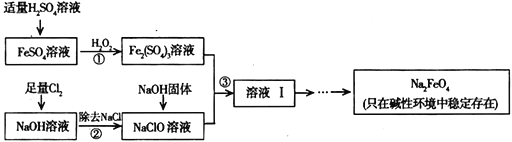
①步骤③中除生成Na2FeO4外,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为____________________________________。
②己知Na2FeO4在强碱性溶液中的溶解度较小。可向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液。从Na2FeO4悬浊液得到固体的操作名称为_____________________。
(4)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_______倍(结果保留两位小数。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,它们虽会对环境造成负面影响,但也是重要的化工原料,其回收利用是环保领域研究的热点课题。
(1)CO 与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L 的密闭容器中投入一定量的CO与Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH=a kJ/ mol。
COCl2(g) ΔH=a kJ/ mol。
反应过程中测定的部分数据如下表:
t/ min | n (CO) /mol | n (Cl2) /mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应从开始到2min 末这一段时间内的平均速率v(COCl2)=_____mol/(L·min)。
②在2min~4min 间,v (Cl2) 正______v (Cl2)逆(填“>”、“<”或“=”),该温度下K=_______。
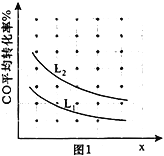
③已知X、L可分别代表温度或压强,图1表示L不同时,CO的转化率随X的变化关系。L代表的物理量是_____________;a_________0(填“>”、“<”或“=”)。
(2)在催化剂作用下NO和CO 可转化为无毒气体:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H
2CO2(g)+N2(g) △H
①已知: N2(g)+O2 (g)=2NO(g) △H1= +180.0kJ/mol
2C(s)+O2 (g)=2CO (g) △H2= -221.0 kJ/mol
2C(s)+2O2 (g)=2CO2 (g) △H3= -787.0 kJ/mol
则ΔH=____________。
②研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。某同学设计了三组实验(实验条件已经填在下面的实验设计表中)。实验的设计目的是___________________________。
实验编号 | T(℃) | NO初始浓度 (mol L-1) | CO初始浓度 (mol L-1) | 催化剂的比表面积(m2 g-1) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
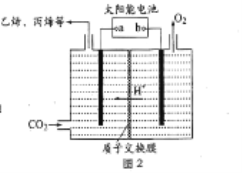
(3)在强酸性的电解质水溶液中,惰性材料作电极,电解CO2可得到多种燃料,其原理如图2 所示。
①b 为电源的_______(填“正”或“负”)极,电解时,生成丙烯的电极反应式是_________。
②侯氏制碱法中可利用CO2、NH3、NaCl等为原料先制得NaHCO3,进而生产出纯碱。已知H2CO3 的Ka1=4.3×10-7 molL-1、Ka2=5.6×10-11 molL-1,NaHCO3溶液中各离子浓度由大到小的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

溶质的物质的量 | 溶液的密度 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为_____(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为_____mol·L-1。
(3)物质的量浓度为c2mol·L-1的氨水与![]() c2mol·L-1的氨水等质量混合,所得溶液的密度_____ (填“大于”、“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度_____
c2mol·L-1的氨水等质量混合,所得溶液的密度_____ (填“大于”、“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度_____![]() c2mol·L-1(设混合后溶液的体积变化忽略不计)。
c2mol·L-1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可做钡餐,BaCO3不能作钡餐的主要理由是( )
A. BaSO4的溶度积常数比BaCO3的小
B. SO![]() 没有毒性,CO
没有毒性,CO![]() 有毒性
有毒性
C. BaSO4的密度大
D. 胃酸能与CO![]() 结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,并用单线桥法标出电子转移的方向和数目:_____________。该反应中,________是还原剂,________是还原产物,被还原的物质是________。
(2)在一定条件下,反应2NH3+3CuO![]() 3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
①该反应是置换反应
②反应中NH3被氧化为N2
③在反应中体现了金属铜的还原性
④在反应中每生成1 mol H2O转移1 mol电子
(3)在反应2H2S+SO2![]() 3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com