
(14·Ö)£Ø1£©Ļņ1 L AlCl3ŗĶFeCl3»ģŗĻČÜŅŗÖŠ¼ÓČėŗ¬a mol NaOHµÄČÜŅŗŹ±£¬²śÉśµÄ³ĮµķĮææÉ“ļ×ī“óÖµ£»¼ĢŠų¼ÓČėNaOHČÜŅŗ£¬³ĮµķæŖŹ¼Čܽā£¬µ±Ē°ŗó¼ÓČėµÄNaOH×ÜĮæ“ļµ½b molŹ±£¬³Įµķ²»ŌŁ¼õÉŁ£¬ŌņŌČÜŅŗÖŠFe3+µÄĪļÖŹµÄĮæÅضČĪŖ £¬AlCl3µÄĪļÖŹµÄĮæ ”£
£Ø2£©ŅŃÖŖ£ŗ2Fe3++2I£””=””2Fe2++ I2£»””””2Fe2++Br2 =””2Fe3++2Br£
¢ŁĻņŗ¬ÓŠ1mol FeI2ŗĶ1.5mol FeBr2µÄČÜŅŗÖŠĶØČė2mol Cl2£¬“ĖŹ±±»Ńõ»ÆµÄĄė×ÓŹĒ”””””£
¢ŚČē¹ūĻņ¢ŁµÄČÜŅŗÖŠĶØČė3mol Cl2£¬Ōņ±»Ńõ»ÆµÄĄė×Ó¶ŌÓ¦µÄŃõ»Æ²śĪļ·Ö±šŹĒ”””””””” ”£
(3£©¢ŁČōm gĢśŠ¼Óėŗ¬ÓŠ n gHNO3µÄĻõĖįČÜŅŗĒ”ŗĆĶźČ«·“Ó¦£¬Čō m : n =" 1" : 2.7£¬ øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ __________________________________________________£Ø¼ŁÉč»¹Ō²śĪļÖ»ÓŠŅ»ÖÖ£¬ĒŅֻɜ³ÉŅ»ÖÖŃĪ£©
¢ŚČōŗ¬ n g HNO3µÄĻ”ĻõĖįČÜŅŗĒ”ŗĆŹ¹5.6gĢś·ŪĶźČ«Čܽā£¬ČōÓŠ n/4 gHNO3±»»¹Ō³ÉNO£ØĪŽĘäĖü»¹Ō²śĪļ£©Ōņ n µÄ·¶Ī§ĪŖ_________________________
¢ŪijĢõ¼žĻĀŠæŗĶĻõĖį·“Ó¦Ź±µÄĪļÖŹµÄĮæÖ®±ČĪŖ2:5£¬“ĖŹ±ĻõĖįµÄ»¹Ō²śĪļŹĒ____________
(14·Ö)(1)£Ø4a-3b £©/3£»b-a (2) ¢ŁI- Fe2+ ¢Ś Fe3+ I2 Br2
£Ø3£©¢Ł 5Fe +12HNO3£½5Fe(NO3)2 + N2”ü + 6H2O ¢Ś16.8 ”Ü n ”Ü 25.2 ¢ŪN2O»ņNH4NO3
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©ÉčAlCl3ŗĶFeCl3µÄĪļÖŹµÄĮæ·Ö±šŹĒxŗĶy£¬Ōņøł¾ŻÓŠ¹Ų·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒAlCl3£«3NaOH=Al(OH)3”ż£«3NaCl”¢FeCl3£«3NaOH=Fe(OH)3”ż£«3NaCl”¢Al(OH)3£«NaOH=NaAlO2£«2H2OæÉÖŖ£¬3x£«3y£½amol”¢x£½bmol£amol£¬½āµĆy£½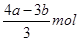 £¬ĖłŅŌĢśĄė×ÓµÄÅØ¶ČŹĒ
£¬ĖłŅŌĢśĄė×ÓµÄÅØ¶ČŹĒ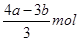 /L”£
/Lӣ
£Ø2£©¢Łøł¾ŻŃõ»Æ»¹Ō·“Ó¦ÖŠ»¹Ō¼ĮµÄ»¹ŌŠŌĒæÓŚ»¹Ō²śĪļµÄæÉÖŖ£¬»¹ŌŠŌĒæČõĖ³ŠņŹĒI££¾Fe2£«£¾Br£”£2molĀČĘųµĆµ½4molµē×Ó£¬1mol FeI2Ź§Č„3mol£¬ĖłŅŌĀČĘų»¹ÄÜŃõ»Æ1molŃĒĢśĄė×Ó”£
¢Ś3molĀČĘųµĆµ½6molµē×Ó£¬ČÜŅŗÖŠµāĄė×ÓÉś³É2molµē×Ó£¬ŃĒĢśĄė×ÓŹ§Č„2.5mol£¬ĖłŅŌ»¹ÄÜŃõ»Æ1.5moläåĄė×Ó£¬¼“Ńõ»Æ²śĪļŹĒFe3+”¢I2”¢Br2”£
£Ø3£©¢ŁĢśŗĶĻõĖįµÄĪļÖŹµÄĮæÖ®±ČŹĒ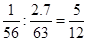 £¬ĖłŅŌŃõ»Æ²śĪļÓ¦øĆŹĒĻõĖįŃĒĢś£¬Ōņ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ5Fe +12HNO3£½5Fe(NO3)2 + N2”ü + 6H2O”£
£¬ĖłŅŌŃõ»Æ²śĪļÓ¦øĆŹĒĻõĖįŃĒĢś£¬Ōņ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ5Fe +12HNO3£½5Fe(NO3)2 + N2”ü + 6H2O”£
¢ŚĻõĖįŗĶĢś·“Ó¦µÄ»Æѧ·½³ĢŹ½æÉÄÜŹĒFe£«4HNO3£½Fe(NO3)3£«NO”ü£«2H2O”¢3Fe£«8HNO3£½3Fe(NO3)2£«2NO”ü£«4H2O”£ÓÉÓŚ·“Ó¦ÖŠÓŠ1/4µÄĻõĖį±»»¹Ō£¬ĖłŅŌøł¾ŻĢśŹĒ0.1molæÉÖŖ£¬ĻõĖįµÄ×īŠ”ÖµŗĶ×ī“óÖµ·Ö±šŹĒ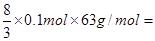 16.8gŗĶ
16.8gŗĶ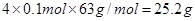 £¬ŌņnµÄȔֵ·¶Ī§ŹĒ16.8 ”Ü n ”Ü 25.2”£
£¬ŌņnµÄȔֵ·¶Ī§ŹĒ16.8 ”Ü n ”Ü 25.2”£
¢ŪÉčŠæµÄĪļÖŹµÄĮæŹĒ2xmol£¬ŌņĻõĖįŹĒ4xmol£¬Éś³ÉĻõĖįŠæŹĒ2xmol£¬ĖłŅŌƻӊ±»»¹ŌµÄĻõĖįŹĒ4xmol£¬Ōņ±»»¹ŌµÄĻõĖįŹĒ5xmol£4xmol£½xmol£¬øł¾Żµē×ӵĵƏ§ŹŲŗćæÉÖŖ£¬ĻõĖįŌŚ·“Ó¦ÖŠµĆµ½4øöµē×Ó£¬¼“»¹Ō²śĪļŹĒN2O£»ĮķĶāČē¹ūƻӊ±»»¹ŌµÄĻõĖį²¢Ć»ÓŠČ«²æŗĶŠæĄė×Ó½įŗĻÉś³ÉĻõĖįŠæ£¬ŌņŅ²æÉÄÜÉś³ÉĻõĖįļ§£¬“ĖŹ±·“Ó¦µÄ»Æѧ·½³ĢŹ½¾ĶŹĒ4Zn£«10HNO3=4Zn(NO3)2£«NH4NO3£«3H2O£¬Ņņ“ĖÕżČ·µÄ“š°øŹĒN2O»ņNH4NO3”£
æ¼µć£ŗæ¼²éĀĮĄė×Ó”¢ĢśĄė×ÓŗĶĒāŃõ»ÆÄĘ·“Ó¦µÄÓŠ¹Ų¼ĘĖć”¢Ńõ»Æ»¹Ō·“Ó¦µÄÓŠ¹ŲÅŠ¶ĻŗĶ¼ĘĖćŅŌ¼°½šŹōŗĶĻõĖį·“Ó¦µÄÓŠ¹ŲÅŠ¶ĻŗĶ½šŹō
µćĘĄ£ŗøĆĢāÄŃ¶Č½Ļ“󣬲ąÖŲæ¼²éѧɜµÄÄÜĮ¦ŗĶ×ŪŗĻĖŲÖŹ£¬¶ŌѧɜµÄ¼ĘĖćÄÜĮ¦Ģį³öĮĖøüøßµÄŅŖĒó”£øĆĢāÓŠĄūÓŚÅąŃųѧɜŃĻ½÷µÄĀß¼Ė¼Ī¬ÄÜĮ¦”¢·¢É¢Ė¼Ī¬ÄÜĮ¦ŅŌ¼°Įé»īÓ¦±äÄÜĮ¦£¬ÓŠĄūÓŚĢįøßѧɜµÄѧĻ°Š§ĀŹŗĶÓ¦ŹŌÄÜĮ¦ŅŌ¼°·ÖĪöĪŹĢā”¢½ā¾öĪŹĢāµÄÄÜĮ¦£¬ŌöĒæѧɜµÄѧĻ°×ŌŠÅŠÄ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
(14·Ö)¶žŃõ»ÆĀČ(ClO2)×÷ĪŖŅ»ÖÖøߊ§ĒæŃõ»Æ¼ĮŅѱ»ĮŖŗĻ¹śŹĄ½ēĪĄÉś×éÖÆ(WHO)ĮŠĪŖAI¼¶°²Č«Ļū¶¾¼Į”£³£ĪĀĻĀ¶žŃõ»ÆĀČĪŖ»ĘĀĢÉ«»ņ飻ĘÉ«ĘųĢ壬ŠŌÖŹ·Ē³£²»ĪČ¶Ø£¬ĪĀ¶Č¹żøß»ņĖ®ČÜŅŗÖŠClO2µÄÖŹĮæ·ÖŹżøßÓŚ30£„µČ¾łÓŠæÉÄÜŅżĘš±¬ÕØ£¬Ņ×Óė¼īŅŗ·“Ӧɜ³ÉŃĪŗĶĖ®”£
£Ø1£©Ä³ŃŠ¾æŠ”×éÉč¼ĘČēĶ¼ĖłŹ¾ŹµŃéÖʱøClO2ČÜŅŗ£¬Ęä·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ
¢ŁŌŚ·“Ó¦æŖŹ¼Ö®Ē°½«ÉÕ±ÖŠµÄĖ®¼ÓČȵ½80”ę£¬Č»ŗóĶ£Ö¹¼ÓČČ£¬²¢Ź¹ĘäĪĀ¶Č±£³ÖŌŚ60”«80”ęÖ®¼ä”£æŲÖĘĪĀ¶ČµÄÄæµÄŹĒ £¬Ķ¼Ź¾×°ÖĆ֊ȱɣµÄŅ»ÖÖ±ŲŠėµÄ²£Į§ŅĒĘ÷ŹĒ
¢Ś×°ÖĆAÓĆÓŚČܽā²śÉśµÄ¶žŃõ»ÆĀČĘųĢ壬ĘäÖŠ×īŗĆŹ¢·Å (Ģī×ÖÄø)”£
A£®20mL 60”ęµÄĪĀĖ® B£®100mL±łĖ®
C£®100mL±„ŗĶŹ³ŃĪĖ® D£®100mL·ŠĖ®
¢ŪŌŚÉÕĘæÖŠ¼ÓČė12.25g KClO3ŗĶ9g²ŻĖį(H2C2O4)£¬Č»ŗóŌŁ¼ÓČė×ćĮæµÄĻ”ĮņĖį£¬Ė®Ō”¼ÓČČ£¬·“Ó¦ŗóÉś³ÉClO2µÄÖŹĮæĪŖ
£Ø2£©ÓĆClO2“¦Ąķ¹żµÄŅūÓĆĖ®(pHĪŖ5.5”«6.5)³£ŗ¬ÓŠŅ»¶ØĮæ¶ŌČĖĢå²»ĄūµÄŃĒĀČĖįøłĄė×Ó()”£ŅūÓĆĖ®ÖŠClO2”¢
µÄŗ¬ĮææÉÓĆĮ¬ŠųµāĮæ·Ø½ųŠŠ²ā¶Ø£¬ŹµŃé²½ÖčČēĻĀ£ŗ
²½Öč1£ŗ×¼Č·ĮæČ”Ņ»¶ØĢå»żµÄĖ®Ńł¼ÓČė׶ŠĪĘæÖŠ£»
²½Öč2£ŗµ÷½ŚĖ®ŃłµÄpHÖĮ7.0”«8.0£»
²½Öč3£ŗ¼ÓČė×ćĮæµÄKI¾§Ģ壻
²½Öč4£ŗ¼ÓČėÉŁĮæÖøŹ¾¼Į£¬ÓĆŅ»¶ØÅØ¶ČµÄNa2S2O3ČÜŅŗµĪ¶ØÖĮÖÕµć£»
²½Öč5£ŗŌŁµ÷½ŚČÜŅŗµÄpH”Ü2.0£»
²½Öč6£ŗ¼ĢŠųÓĆĻąĶ¬ÅØ¶ČµÄNa2S2O3ČÜŅŗµĪ¶ØÖĮÖÕµć”£
¢Ł²½Öč1ÖŠČōŅŖĮæČ”20.00mLĖ®Ńł£¬ŌņӦєÓƵÄŅĒĘ÷ŹĒ
¢Ś²½Öč1”«4µÄÄæµÄŹĒ²ā¶ØĖ®ŃłÖŠClO2µÄŗ¬Į棬Ęä·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ:
£¬Ōņ²½Öč4ÖŠ¼ÓČėµÄÖøŹ¾¼ĮĪŖ £¬µĪ¶Ø“ļµ½ÖÕµćŹ±ČÜŅŗµÄŃÕÉ«±ä»ÆĪŖ
¢Ū²½Öč5µÄÄæµÄŹĒŹ¹½«ČÜŅŗÖŠµÄ
»¹ŌĪŖ
ŅŌ²ā¶ØĘäŗ¬Į棬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ
¢ÜČōŅūÓĆĖ®ÖŠµÄŗ¬Į泬±ź£¬æÉĻņĘäÖŠ¼ÓČėŹŹĮæµÄ
½«
»¹ŌĪŖ
£¬ŌņøĆ·“Ó¦µÄŃõ»Æ²śĪļĪŖ (Ģī»ÆѧŹ½)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014½ģ½ĖÕĢ©ÖŻ¶žÖŠø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»Æѧ£ØŃ”ŠŽ£©ŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
(14·Ö)ÓŠĮ½Ö»ĆܱÕČŻĘ÷AŗĶB£¬AÄܱ£³ÖŗćČŻ£¬BÄܱ£³ÖŗćŃ¹”£ĘšŹ¼Ź±ĻņČŻ»żĻąµČµÄA”¢BÖŠ·Ö±šĶØČėµČĮæµÄNH3ĘųĢ壬Ź¹Ö®·¢Éś·“Ó¦£ŗ2NH3(g)  3H2(g)£«N2(g)£¬²¢“ļµ½Ę½ŗā”£Ōņ£ŗ
3H2(g)£«N2(g)£¬²¢“ļµ½Ę½ŗā”£Ōņ£ŗ
£Ø1£©“ļµ½Ę½ŗāĖłŠčŅŖµÄŹ±¼ä£ŗt(A) t(B)£¬NH3µÄ×Ŗ»ÆĀŹ£ŗa(A) a(B) (Ģī”°>”±”¢”°=”±»ņ”°<”±)”£
£Ø2£©·“Ó¦¹ż³ĢÖŠµÄ·“Ó¦ĖŁĀŹ£ŗv(A) v(B) (Ģī”°>”±”¢”°=”±»ņ”°<”±)”£
£Ø3£©“ļµ½Ę½ŗāŗó£¬ŌŚĮ½ČŻĘ÷ÖŠ·Ö±šĶØČėµČĮæµÄŗ¤Ęų”£ŌņBÖŠµÄ»ÆŃ§Ę½ŗāĻņ ·“Ó¦·½ĻņŅĘ¶Æ£¬AÖŠµÄ»Æѧ·“Ó¦ĖŁĀŹ (Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)”£
£Ø4£©“ļµ½Ę½ŗāŗó£¬ĻņĮ½ČŻĘ÷ÖŠ·Ö±šĶØČėµČĮæµÄŌ·“Ó¦ĘųĢ壬ŌŁ“Ī“ļµ½Ę½ŗāŹ±£¬AČŻĘ÷ÖŠH2µÄ°Ł·Öŗ¬Įæ £¬BČŻĘ÷ÖŠNH3µÄ°Ł·Öŗ¬Įæ (Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012Äź½Ī÷Ź”ø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»Æѧ£ØĄķ£©ŹŌĢā ĢāŠĶ£ŗĢīæÕĢā
(14·Ö)ŅŃÖŖCO2(g)£«H2(g) CO(g)£«H2O(g)µÄĘ½ŗā³£ŹżĖęĪĀ¶Č±ä»ÆČēĻĀ±ķ£ŗ
CO(g)£«H2O(g)µÄĘ½ŗā³£ŹżĖęĪĀ¶Č±ä»ÆČēĻĀ±ķ£ŗ
|
t/”ę |
700 |
800 |
850 |
1 000 |
1 200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ÉĻŹöÕżĻņ·“Ó¦ŹĒ________·“Ó¦(Ń”Ģī”°·ÅČČ”±»ņ”°ĪüČČ”±)”£
(2)Čō“ļĘ½ŗāŗó½µĪĀ£¬ŌņĘ½ŗāĻņ________ŅĘ¶Æ£¬CO2×Ŗ»ÆĀŹ________£¬Õż·“Ó¦ĖŁĀŹ________(Ń”Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)”£
(3)ŌŚ850”ę·¢ÉśÉĻŹö·“Ó¦£¬ŅŌ±ķÖŠµÄĪļÖŹµÄĮæĶ¶ČėŗćČŻ·“Ó¦Ę÷ÖŠ£¬ĘäÖŠĻņÕż·“Ó¦·½ĻņŅĘ¶ÆµÄÓŠ________(Ń”ĢīA”¢B”¢C”¢D”¢E)
|
|
A |
B |
C |
D |
E |
|
n(CO2) |
3 |
1 |
0 |
1 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
2 |
1 |
(4)ŌŚ850”ꏱ£¬æÉÄę·“Ó¦£ŗCO2(g)£«H2(g) CO(g)£«H2O(g)£¬ŌŚøĆČŻĘ÷ÄŚø÷ĪļÖŹµÄÅØ¶Č±ä»ÆČēĻĀ£ŗ
CO(g)£«H2O(g)£¬ŌŚøĆČŻĘ÷ÄŚø÷ĪļÖŹµÄÅØ¶Č±ä»ÆČēĻĀ£ŗ
|
Ź±¼ä/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2O (mol/L) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
Ōņ3 min”«4 minĘ½ŗāŗóc3£½______________£¬CO2µÄ×Ŗ»ÆĀŹĪŖ____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013½ģÄźĢģ½ņŹŠµČČżŠ£ø߶žÉĻѧʌʌĩĮŖæ¼»ÆѧŹŌ¾ķ ĢāŠĶ£ŗĢīæÕĢā
£Ø¹²14·Ö£©ŹµĻÖ ”°½ŚÄܼõÅÅ”± ŗĶ”°µĶĢ¼¾¼Ć”±µÄŅ»ĻīÖŲŅŖæĪĢā¾ĶŹĒČēŗĪ½«CO2×Ŗ»ÆĪŖæÉĄūÓƵÄ׏Ō“”£ÄæĒ°¹¤ŅµÉĻÓŠŅ»ÖÖ·½·ØŹĒÓĆCO2Ą“Éś²śČ¼ĮĻ¼×“¼”£Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗ
CO2(g)+3H2(g) CH3OH(g)+H2O(g)£¬ĻĀĶ¼1±ķŹ¾øĆ·“Ó¦¹ż³ĢÖŠÄÜĮæ(µ„Ī»ĪŖkJ”¤mol-1)µÄ±ä»Æ£ŗ
CH3OH(g)+H2O(g)£¬ĻĀĶ¼1±ķŹ¾øĆ·“Ó¦¹ż³ĢÖŠÄÜĮæ(µ„Ī»ĪŖkJ”¤mol-1)µÄ±ä»Æ£ŗ
£Ø1£©¹ŲÓŚøĆ·“Ó¦µÄĻĀĮŠĖµ·ØÖŠ£¬ÕżČ·µÄŹĒ____________(Ģī×ÖÄø)”£
A£®DH£¾0£¬DS£¾0 B£®DH£¾0£¬DS£¼0 C£®DH£¼0£¬DS£¼0 D£®DH£¼0£¬DS£¾0
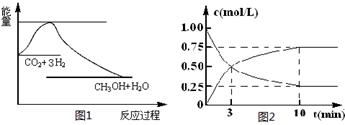
£Ø2£©ĪŖĢ½¾æ·“Ó¦ŌĄķ£¬ĻÖ½ųŠŠČēĻĀŹµŃ飬ŌŚĢå»żĪŖl LµÄĆܱÕČŻĘ÷ÖŠ£¬³äČėl mol CO2ŗĶ3mol H2£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO2(g)+3H2(g) CH3OH(g)+H2O(g)£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēÉĻĶ¼2ĖłŹ¾”£
CH3OH(g)+H2O(g)£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēÉĻĶ¼2ĖłŹ¾”£
¢Ł“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬CH3OHµÄĘ½¾ł·“Ó¦ĖŁĀŹv(CH3OH) £½ mol”¤(L”¤min)-1£»
H2µÄ×Ŗ»ÆĀŹw(H2) =
¢ŚøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½K£½
¢ŪĻĀĮŠ“ėŹ©ÖŠÄÜŹ¹»ÆŃ§Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶ÆµÄŹĒ (Ģī×ÖÄø)”£
A£®ÉżøßĪĀ¶Č B£®½«CH3OH(g)¼°Ź±Ņŗ»Æ³é³ö
C£®Ń”Ōńøߊ§“߻ƼĮ D£®ŌŁ³äČėl molCO2ŗĶ3 molH2
£Ø3£©25”ę£¬1.01”Į105PaŹ±£¬16g ŅŗĢ¬¼×“¼ĶźČ«Č¼ÉÕ£¬µ±»Öø“µ½ŌדĢ¬Ź±£¬·Å³ö363.3kJµÄČČĮ棬Š“³ö±ķŹ¾CH3OHČ¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½£ŗ
£Ø4£©Ń”ÓĆŗĻŹŹµÄŗĻ½šĪŖµē¼«£¬ŅŌĒāŃõ»ÆÄĘ”¢¼×“¼”¢Ė®”¢ŃõĘųĪŖŌĮĻ£¬æÉŅŌÖĘ³ÉŅ»ÖÖŅŌ¼×“¼ĪŖŌĮĻµÄČ¼ĮĻµē³Ų£¬“Ėµē³ŲµÄøŗ¼«µē¼«·“Ó¦Ź½
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
(14·Ö)ŅŃÖŖCO2(g)£«H2(g)CO(g)£«H2O(g)µÄĘ½ŗā³£ŹżĖęĪĀ¶Č±ä»ÆČēĻĀ±ķ£ŗ
| t/”ę | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ÉĻŹöÕżĻņ·“Ó¦ŹĒ________·“Ó¦(Ń”Ģī”°·ÅČČ”±»ņ”°ĪüČČ”±)”£
(2)Čō“ļĘ½ŗāŗó½µĪĀ£¬ŌņĘ½ŗāĻņ________ŅĘ¶Æ£¬CO2×Ŗ»ÆĀŹ________£¬Õż·“Ó¦ĖŁĀŹ________(Ń”Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)”£
(3)ŌŚ850”ę·¢ÉśÉĻŹö·“Ó¦£¬ŅŌ±ķÖŠµÄĪļÖŹµÄĮæĶ¶ČėŗćČŻ·“Ó¦Ę÷ÖŠ£¬ĘäÖŠĻņÕż·“Ó¦·½ĻņŅĘ¶ÆµÄÓŠ________(Ń”ĢīA”¢B”¢C”¢D”¢E)
|
| A | B | C | D | E |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
(4)ŌŚ850”ꏱ£¬æÉÄę·“Ó¦£ŗCO2(g)£«H2(g)CO(g)£«H2O(g)£¬ŌŚøĆČŻĘ÷ÄŚø÷ĪļÖŹµÄÅØ¶Č±ä»ÆČēĻĀ£ŗ
| Ź±¼ä/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O (mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
Ōņ3 min”«4 minĘ½ŗāŗóc3£½______________£¬CO2µÄ×Ŗ»ÆĀŹĪŖ____________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com