
 合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.
合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
分析 (1)①根据化学平衡常数=$\frac{生成物平衡浓度系数次方的乘积}{反应物平衡浓度系数次方的乘积}$书写表达式;
②根据温度对平衡常数的影响,对于放热反应,温度越高,K越小;
③反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 是气体体积减小的放热反应,所以理论上,为了增大平衡时H2的转化率,可采取加压、降温、降低产物浓度等方法,催化剂对转化率没有影响;
(2)①正反应为气体物质的量增大的反应,增大压强平衡逆向移动,混合气体中甲烷的含量增大;
②由图可知,随温度升高甲烷的含量减小,说明升高温度平衡正向移动,而升高温度平衡向吸热反应移动;
(3)①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则:
CO(g)+H2O(g)?CO2(g)+H2 (g)
起始浓度(mol/L):0.2 0.2 0 0
变化浓度(mol/L):0.12 0.12 0.12 0.12
平衡浓度(mol/L):0.08 0.08 0.12 0.12
平衡时CO的转化率=$\frac{CO浓度变化量}{CO起始浓度}$×100%;平衡常数K=$\frac{c(CO{\;}_{2})×c(H{\;}_{2})}{c(CO)×c(H{\;}_{2}O)}$;
②可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡,D选项计算浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.
解答 解:(1)①根据化学平衡常数=$\frac{生成物平衡浓度系数次方的乘积}{反应物平衡浓度系数次方的乘积}$可知,该反应的平衡常数K=$\frac{[NH{\;}_{3}]^{2}}{[N{\;}_{2}][H{\;}_{2}]{\;}^{3}}$,
故答案为:$\frac{[NH{\;}_{3}]^{2}}{[N{\;}_{2}][H{\;}_{2}]{\;}^{3}}$;
②合成氨反应N2(g)+3H2(g) 2NH3(g)△H<0,对于放热反应,温度越高,K越小,所以K1>K2,
2NH3(g)△H<0,对于放热反应,温度越高,K越小,所以K1>K2,
故答案为:>.
③反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 是气体体积减小的放热反应,所以理论上,为了增大平衡时H2的转化率,可采取加压、降温、降低产物浓度等方法,催化剂对转化率没有影响,故选a、d;
(2)①正反应为气体物质的量增大的反应,增大压强平衡逆向移动,混合气体中甲烷的含量增大,所以P2>P1,
故答案为:<;
②由图可知,随温度升高甲烷的含量减小,说明升高温度平衡正向移动,而升高温度平衡向吸热反应移动,故正反应为吸热反应,
故答案为:吸热;
(3)①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则:
CO(g)+H2O(g)?CO2(g)+H2 (g)
起始浓度(mol/L):0.2 0.2 0 0
变化浓度(mol/L):0.12 0.12 0.12 0.12
平衡浓度(mol/L):0.08 0.08 0.12 0.12
平衡时CO的转化率=$\frac{0.12mol}{0.2mol}$×100%=60%;平衡常数K=$\frac{c(CO{\;}_{2})×c(H{\;}_{2})}{c(CO)×c(H{\;}_{2}O)}$=$\frac{0.12×0.12}{0.08×0.08}$=2.25,
故答案为:60%;2.25;
②a.反应中混合气体物质的量不变,容器内压强不随时间改变,不能说明反应达到平衡状态,故a不符合;
b.混合气体质量不变,容器容积不变,混合气体的密度不随时间改变,不能说明反应达到平衡状态,故b不符合;
c.单位时间内生成amolCO2的同时消耗amolH2,说明二氧化碳或氢气的正逆反应速率相同,说明反应达到平衡状态,故c符合;
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6,反应前后气体物质的量相同,可以利用物质的量代替浓度计算浓度商和平衡常数比较,Qc=$\frac{6×6}{1×16}$=2.25=K,说明反应达到平衡状态,故d符合,
故答案为:cd.
点评 本题考查化学平衡计算与影响因素、平衡状态的判断、平衡常数计算及应用等,难度中等,(3)中平衡状态判断d选项中注意利用浓度商与平衡常数关系分析.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

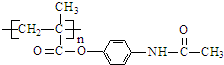 .
.

 与1mol O2恰好可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
与1mol O2恰好可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式 .
. ;扑热息痛的结构简式为
;扑热息痛的结构简式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水的电离平衡如图所示.
水的电离平衡如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,1.01×105Pa时,32 g O2和O3的混合气体所含原子数为2NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| C. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| D. | 在常温常压下,22.4 LCO2含有的原子数约为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 碘易溶于酒精,所以用酒精从碘水中萃取碘 | |
| C. | 液溴应保存在磨口玻璃塞试剂瓶中,并加少量水进行水封? | |
| D. | 检验某溶液是否含有SO42- 时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com