
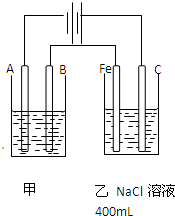
 如图所示,甲、乙为互相串联的两个电解池.请回答
如图所示,甲、乙为互相串联的两个电解池.请回答

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
| A、酸式滴定管用蒸馏水洗后未用标准液润洗就装标准液滴定 |
| B、锥形瓶未用待测液润洗 |
| C、读取标准液读数时,滴前仰视,滴定到终点后俯视 |
| D、滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
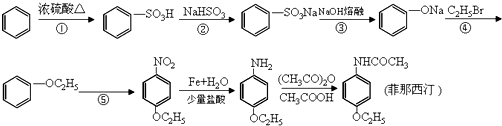
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.05×10-4 |
| B、2.03×10-4 |
| C、1.28×10-4? |
| D、2.90×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
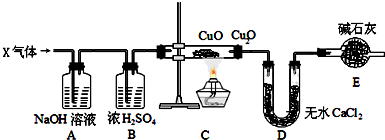
查看答案和解析>>
科目:高中化学 来源: 题型:

| 序号 | 实验现象 | 结 论 |
| A | 热水中平衡球颜色比冷水中深 | 升温,化学平衡向吸热反应方向移动 |
| B | 起始时产生气泡速率HCl>CH3COOH | 醋酸是弱电解质 |
| C | 溶液颜色由黄变橙,且30秒内不变色 | 已达滴定终点 |
| D | 划口处有蓝色沉淀 | 铁发生了析氢腐蚀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

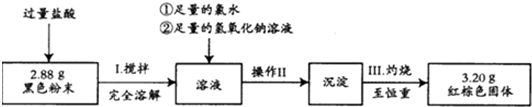
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com