


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加MgSO4 |
| B、加HCl溶液 |
| C、加NaOH |
| D、加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgX | B、AgY |
| C、AgZ | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl |
| B、NaOH固体 |
| C、MgCl2固体 |
| D、NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
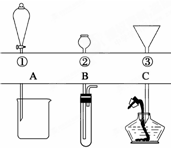 如图所示,①~③是几种漏斗的上部,A、B、C是实际操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图.请根据实际操作时上述漏斗的使用范围和它们的形状,指出A~C分别与①~③中哪一种最匹配(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).A与
如图所示,①~③是几种漏斗的上部,A、B、C是实际操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图.请根据实际操作时上述漏斗的使用范围和它们的形状,指出A~C分别与①~③中哪一种最匹配(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).A与查看答案和解析>>
科目:高中化学 来源: 题型:
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com