


科目:高中化学 来源: 题型:
| OH- |
| H- |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) |
| B、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 |
| C、常温下将pH=7.40的血液稀释至pH=7时,c(H+)?c(OH-)一定不变 |
| D、c(HCO3-):c(H2CO3)=1时,H2CO3的电离程度小于HCO3-的水解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
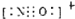
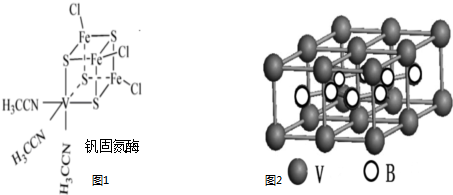
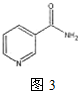
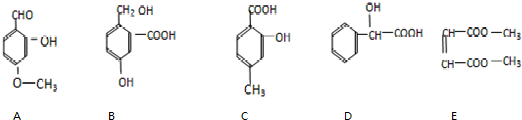
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||||
| ⑨ | ⑩ | ||||||||||||||||
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | F | Ne | |||||
| 3 | Na | Mg | Al | Si | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24.4g |
| B、13.2g |
| C、12.5g |
| D、11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三个美国科学家因给复杂化学体系设计了多尺度模型而共享了2013年诺贝尔化学奖 |
| B、已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则受PM2.5污染的大气不一定能产生丁达尔现象 |
| C、借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 |
| D、并不是所有金属元素都可以用焰色反应来确定其存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com