
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 热稳定性H2O>H2Se>H2S |
分析 A、根据同周期原子半径的递变规律:同周期元素原子的半径从左到右依次减小解答;
B、根据同周期气态氢化物的递变规律:从左到右逐渐增强可以判断;
C、根据同周期、同主族最高价含氧酸的递变规律可以得出正确判断;
D、原子的得电子能力越强,氢化物的稳定性越强,据此回答.
解答 解:A.同周期元素原子的半径从左到右依次减小,则原子半径:Al<Mg<Na,故A错误;
B.同周期元素气态氢化物的稳定性从左到右逐渐增强,即热稳定性:HCl>H2S>PH3,故B正确;
C.同周期最高价氧化物对应水合物的酸性从左到右依次增强(Si、P同周期),同主族最高价氧化物对应水合物的酸性从上到下依次减弱(C、Si同主族),
则酸性强弱:H2SiO4<H2CO3<H2SO4,故C正确;
D、原子的得电子能力顺序:O>S>Se,所以热稳定性H2O>H2Se>H2S,故D正确.
故选A.
点评 本题考查的主要是同周期元素性质的递变规律,运用递变规律解题要判断是同周期还是同主族,才能正确运用规律.


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| (1)实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为2.8g |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 用玻璃棒搅拌至完全溶解,冷却至室温 |
| ④将烧杯中溶液转移至仪器A中(已检查不漏水) | 仪器A是100mL容量瓶; |
| ⑤洗涤烧杯,转移,定容 | |
| ⑥摇匀、装瓶、贴上标签 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
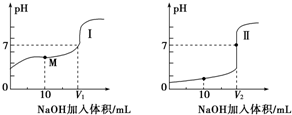
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
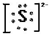
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
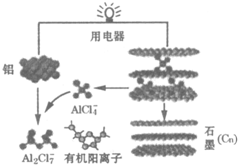
| A. | 放电时,有机阳离子向铝电极方向移动 | |
| B. | 充电时,铝电极连接外加电源的正极,石墨电极连接外加电源的负极 | |
| C. | 放电时负极的电极反应为:Al-3e-+7AlCl4-=4Al2Cl7- | |
| D. | 该电池的工作原理为:3Cn+4Al2Cl7-$?_{充电}^{放电}$3CnAlCl4+Al+AlCl4- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com