
(16分)
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 molL-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 molL-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 molL-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 molL-1 FeCl3溶液中滴加2滴0.1 molL-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;②实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ① molL-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是 ② 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
步骤 | 试剂及操作 | 现 象 |
i | ③ | 生成白色沉淀 |
ii | 向i所得溶液中滴加0.1 molL-1 FeCl3溶液 | ④ |
(16分)
(1)2Fe2++ H2O2 + 2H+ === 2Fe3++ 2H2O Fe3++3SCN- Fe(SCN)3(不写可逆号不扣分)
Fe(SCN)3(不写可逆号不扣分)
(2)①溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应
②排除H2O2分解产生的O2氧化SCN-的可能
(3)
①0.15
②H2O2将Fe2+氧化为Fe3+,pH增大促进Fe3+水解形成红色Fe(OH)3胶体
③取2 mL BaCl2溶液,滴加2滴0.1 mol·L-1KSCN溶液和5滴5% H2O2溶液(多答盐酸或答酸化BaCl2溶液为0分,答错一种试剂即为0分)
④无明显现象
【解析】
试题分析:(1)Fe2+被H2O2氧化生成Fe3+,再与SCN-形成血红色的Fe(SCN)3;(2)Ⅰ、①取褪色后溶液两份,一份滴加FeCl3溶液无现象,说明溶液中SCN-离子不存在;另一份滴加KSCN溶液出现红色说明溶液中存在Fe3+;②实验Ⅲ的目的是排除H2O2分解产生的O2氧化SCN-的可能,如果氧气氧化SCN-,红色应褪去,但现通入氧气无现象说明氧气没有氧化SCN-;(3)由2Fe3++Fe=3Fe2+可知配制的FeCl2的浓度应为原FeCl3浓度的1.5倍;Ⅰ.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,说明H2O2氧化Fe2+使溶液pH增大,促进Fe3+水解生成Fe(OH)3胶体;后者无丁达尔效应,说明硫氰化铁溶液不能产生丁达尔效应;Ⅱ.如果SCN-被双氧水氧化,生成硫酸根离子,再加入Fe3+无明显现象,说明硫氰化钾已被氧化.
考点:了解Fe2+、Fe3+的性质及检验方法。设计、评:价或改进实验方案。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:选择题
实验设计是化学实验的重要技能之一。用所给装置(夹持装置省略)完成相关实验,最合理的选项是
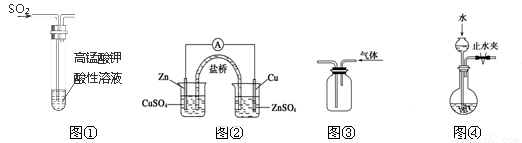
A.图①中KMnO4溶液紫红色褪去,说明SO2具有漂白性
B.图②能构成铜锌原电池
C.图③利用排空气法收集二氧化碳
D.图④检查装置气密性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.常温下,某NaHSO3溶液的pH<7,则该溶液中c(SO32-)<c(H2SO3)
B.25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,所消耗溶液体积为:V(醋酸溶液)>V(NaOH溶液)
C.将l mL pH=2的醋酸溶液加水稀释到10 mL,pH变为3
D.常温下,将Na2CO3溶液加水稀释, 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北大冶一中等六校高三元月调考理综化学试卷(解析版) 题型:填空题
【化学—选修2:化学与技术】(15分)
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 ;用这种方法处理SO2废气的优点是 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:

①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 。
②下列有关说法正确的是 (填序号)。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应III中发生反应的化学方程式为CaSO4+4C CaS+4CO↑
CaS+4CO↑
C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应V中的副产物氯化铵可用作氮肥
③反应V中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北大冶一中等六校高三元月调考理综化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4
B.25℃时Ksp(AgCl)=1.8×10—10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能增大
C.浓度均为0.1 mol·L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4
D.为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2===NO3-+NO↑+H2O
B.碳酸氢钠溶液与过量的澄清石灰水反应:2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应:2MnO4-+6H++5H2O2===2Mn2++5O2↑+8H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++SO42-+Ba2++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
下列有关化学用语正确的是
①乙烯的最简式C2H4 ②乙醇的结构简式C2H6O
③四氯化碳的电子式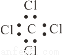 ④乙炔的结构简式CHCH
④乙炔的结构简式CHCH
⑤乙烷的结构式CH3CH3 ⑥乙醛的结构简式CH3COH
A.全对 B.全错 C.③④⑤ D.③④⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:选择题
新一代锂电池的反应为:FePO4+Li LiFePO4该电池可用于电动汽车,其以含Li+的导电固体为电解质。下列有关LiFePO4电池说法正确的是
LiFePO4该电池可用于电动汽车,其以含Li+的导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
B.充电时LiFePO4只发生氧化反应不发生还原反应
C.充电过程中,电池正极材料的质量增加
D.加入硫酸可以提高电解质的导电性
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省攀枝花市高一上学期期末考试化学试卷(解析版) 题型:计算题
(4分)请回答下列问题:
(1)设NA代表阿伏加德罗常数的数值,一个CO分子的质量可表示为 g。
(2)由O2和CO2组成的18 g混合气体在标准状况下的体积为11.2 L,则原混合气体的平均摩尔质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com