
| A. | 食盐 | B. | 硫磺 | C. | 金刚石 | D. | 钨 |
科目:高中化学 来源: 题型:解答题
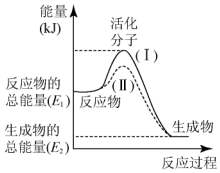 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
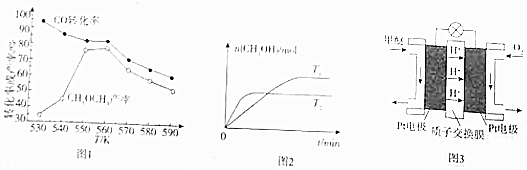
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

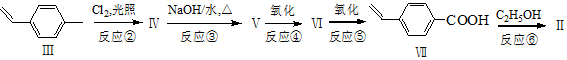
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合气体中H2S的体积可能是75mL | |
| B. | 原混合气体中O2的体积可能是50mL | |
| C. | 剩余25 mL气体可能全部是SO2 | |
| D. | 剩余25 mL气体可能是SO2与O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Mg 在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 室温时,1.0 L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸气反应生成22.4L氢气,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通人过量氯气:Fe2+、NH4+、H+、SO42-、Cl- | |
| B. | 加入少量 NaClO溶液:Fe2+、NH4+、SO42-、H+、ClO | |
| C. | 加入过量 NaOH 溶液:Na+、Fe2+、NH4+、SO42-、OH- | |
| D. | 加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com