
| A. | 增加C的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入一定量的H2O(g) | |
| D. | 保持压强不变,充入N2使容器体积变大 |
分析 该反应是反应前后气体体积增大的可逆反应,温度、气体物质浓度、催化剂、压强都影响反应速率,以此解答该题.
解答 解:A.碳是固体,改变固体的质量,反应速率不变,故A选;
B.将容器的体积缩小一半,反应体系中物质的浓度增大,则化学反应速率增大,故B不选;
C.保持体积不变,充入水蒸气,使体系压强增大,反应速率加快,故C不选;
D.容器的体积一定增大,反应速率降低,故D不选.
故选A.
点评 该题是基础性试题的考查,也是高考中的常见考点.试题难易适中,基础性强,侧重对学生基础知识的巩固与训练,有利于培养学生运用基础知识解决实际问题的能力.该题的关键是明确几种概念的含义,特别是概念的内涵和外延,以及判断依据,然后结合题意灵活运用即可,有利于调动学生的学习兴趣和学习积极性.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
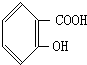 、
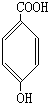
、 、
、
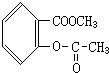 、
、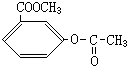 、
、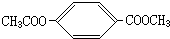 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
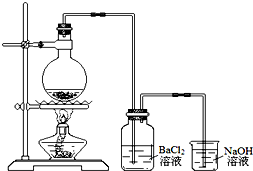 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中 Br-、NO3-、Na+、SO32- | |
| B. | 由水电离出的C(H+)=1×10 -12 mol•L-1的溶液:K+、Ba2+、HCO3-、Cl- | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、NO3-、SO42- | |
| D. | c(H+)/c(OH-)=1×10 -12的溶液:Ca2+、Fe3+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | B. | c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | ||
| C. | c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | D. | c(Na+)+c(OH-)=c(CH3COO-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(aq) | B. | HCl(aq) | C. | Fe2(SO4)3(aq) | D. | CuSO4(aq) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com