
| A. | 丙的阳离子可能不是主族元素 | B. | 乙可能是硝酸铝 | ||
| C. | 甲可能是硫酸钠 | D. | 所得溶液呈弱酸性 |
分析 等物质的量的甲、乙、丙三种可溶性盐溶于水,所得溶液中只含有Al3+、Na+、NO3-、Cl-、SO42-五种离子,同时生成一种白色沉淀,甲、乙、丙三种可溶性盐,其所含阳离子的原子序数依次增大,分别为Na+、Al3+、Ag+,因等物质的量混合,生成沉淀可能为AgCl,溶液中仍含有氯离子,则甲为硫酸盐,乙为盐酸盐,丙为硝酸盐,以此来解答.
解答 解:等物质的量的甲、乙、丙三种可溶性盐溶于水,所得溶液中只含有Al3+、Na+、NO3-、Cl-、SO42-五种离子,同时生成一种白色沉淀,生成沉淀可能为AgCl,甲、乙、丙三种可溶性盐,其含阳离子的原子序数依次增大,分别为Na+、Al3+、Ag+,等物质的量混合,生成沉淀可能为AgCl,溶液中仍含有氯离子,则甲为Na2SO4、乙为AlCl3、丙为AgNO3.
A.丙为AgNO3,Ag+不是主族元素,故A不选;
B.若乙可能是硝酸铝,甲为Na2SO4、乙为Al(NO3)3、丙为AgCl,或甲为NaCl、乙为Al(NO3)3、丙为Ag2SO4,氯化银难溶于水、硫酸银微溶于水,与甲、乙、丙三种可溶性盐矛盾,故B错误;
C.若甲为Na2SO4、乙为Al(NO3)3、丙为AgCl,氯化银难溶于水,不成立,或甲为Na2SO4、乙为AlCl3、丙为AgNO3,等物质的量混合,生成沉淀为AgCl,溶液中仍含有氯离子,成立,故C正确;
D.甲为Na2SO4、乙为AlCl3、丙为AgNO3,等物质的量的甲、乙、丙三种混合,生成沉淀为AgCl,溶液中还含有下列五种离子:Al3+、Na+、NO3-、Cl-、SO42-.
为强酸弱碱盐,水解呈酸性,故D正确;
故选B.
点评 本题考查了物质的推断,注意阳离子的原子序数依次增大、等物质的量的三种物质混合后溶于水,产生白色沉淀为解答的关键,侧重分析能力及推断能力的考查,题目难度中等.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:解答题
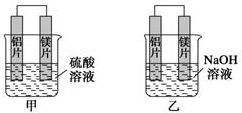
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴、阳离子通过静电吸引形成的强烈的相互作用 | |
| B. | 只由非金属元素组成的化合物不可能是离子化合物 | |
| C. | 金属元素与非金属元素化合时,不一定形成离子键 | |
| D. | 只有活泼金属与活泼非金属之间才能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
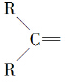 ”生成酮,“
”生成酮,“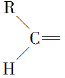 ”生成“
”生成“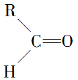 ”,
”,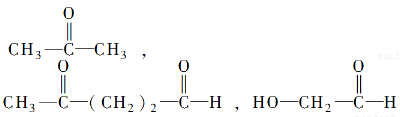
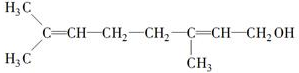 或
或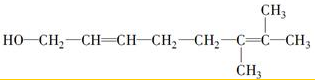 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
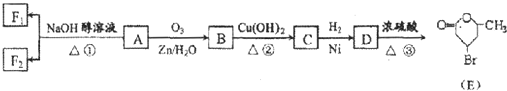
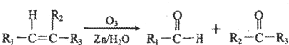
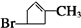
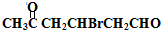 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$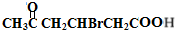 +Cu2O↓+2H2O
+Cu2O↓+2H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
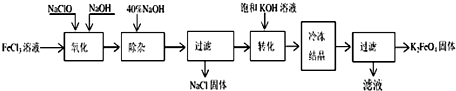
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2的催化氧化反应是吸热反应 | |
| B. | SO2的转化率一定为20% | |
| C. | 导出气体中SO3所占的体积分数为$\frac{2}{9}$ | |
| D. | 单位时间内进人接触室的气体与从接触室导出的气体的物质的量之比为10:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
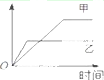 表格中的各种情况,可以用如图的曲线表示的是( )
表格中的各种情况,可以用如图的曲线表示的是( ) | 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中 2NH3═N2+3H2 △H<0 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 向温度和压强都相同的甲乙两容器中分别投入体积比1:3的N2、H2(N2+3H2═2NH3) | 氨气的物质的量 | 反应过程中保持恒温恒容 | 反 应过程中保持恒温恒压 |
| D | 2molSO2和1molO2,在相同温度下 2SO2+O2═2SO3 | SO3 的浓度 | 2个大气压 | 10个大气压 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com