
分类是学习和研究化学的一种重要方法,下列分类合理的是
A.K2CO3和K2O都属于盐
B.Na2O和Na2SiO3都属于氧化物
C.KOH和Na2CO3都属于碱
D.H2SO4和HNO3都属于酸
科目:高中化学 来源:2014秋广东省广州市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
可以用于鉴别淀粉溶液和蛋白质溶液的方法是
A.分别加入碘水,观察颜色反应
B.分别加热,观察是否生成沉淀
C.加入淀粉酶观察是否水解
D.分别灼烧,闻味道
查看答案和解析>>
科目:高中化学 来源:2014秋广东省广州市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
保护环境是每一个公民的责任,下列做法:①推广使用无磷洗涤剂;②城市生活垃圾分类处理;③推广使用一次性木质筷子;④推广使用清洁能源;⑤过量使用化肥、农药;⑥推广使用无氟冰箱。其中有利于保护环境的是
A.①②④⑤ B.②③④⑥ C.①②④⑥ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014秋广东省广州市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
下表是食用碘盐包装上的部分说明,下列说法正确的是
配料 | 精盐、碘酸钾、抗结剂 |
碘含量 | 35±15 mg·kg-1 |
储存方法 | 密封、避光、防潮 |
食用方法 | 烹饪时,待食品熟后加入碘盐 |
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.可用淀粉检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50 mg·kg-1
查看答案和解析>>
科目:高中化学 来源:2014秋广东省广州市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
可检查淀粉部分发生水解的试剂是
A、碘水 B、碘化钾溶液
C、硝酸银溶液 D、银氨溶液、碘水
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省高二上学期期中化学试卷(解析版) 题型:填空题
(8分)氨气主要用作致冷剂及制取铵盐和氨肥
(1)某研究小组在673K、30MPa条件下,在体积为VL的密闭容器中进行反应:N2(g)+3H2(g)? 2NH3(g),其n(H2)和n(NH3)随时间变化的关系如图所示.
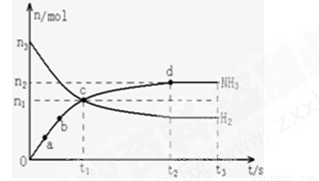
下列叙述正确的是 .
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若t3时由673K升至773K,则n(H2)将增大
D.t2、t3时刻,n(N2)不相等
(2)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.①3min内以H2表示的化学反应速率 ;②该条件下的平衡常数
(3)已知:N2(g)+O2(g)=2NO(g)△H= +180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H= -483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省宿州市高二上学期期中化学(理)试卷(解析版) 题型:填空题
(16分)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)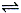 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物 质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
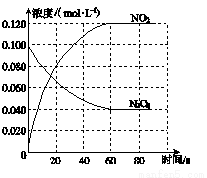
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com