
【题目】下列离子方程式中,正确的是 ( )
A.NH4HCO3溶液中加入过量的NaOH溶液并加热:NH4++OH- ![]() NH3↑+H2O
NH3↑+H2O
B.铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
C.向NaHSO4溶液中滴加Ba(OH)2溶液至SO42-离子恰好沉淀完全:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D.NH4HCO3溶液与过量HCl溶液混合:HCO3-+H+=CO2↑+H2O
科目:高中化学 来源: 题型:
【题目】将反应Cu(s) + 2Ag+(aq)![]() Cu2+(aq) + 2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是 ( )
Cu2+(aq) + 2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是 ( )
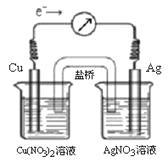
A. KNO3盐桥中的K+移向Cu(NO3)2溶液
B. 当电流计指针为0时,该反应达平衡,平衡常数K=0
C. 若此时向AgNO3溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转
D. 若此时向Cu(NO3)2溶液中加入NaOH固体,随着NaOH量的增加电流计指针向右偏转幅度减小→指针指向0→向左偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不锈钢是由铁、铬(Cr)、镍(Ni)、碳、硅及众多不同元素组成的合金。完成下列填空:
(1)写出碳原子最外层电子的轨道表示式______________,其最外层有____种不同运动状态的电子。
(2)硅烷(SiH4)可用于制备高纯硅,已知硅烷的分解温度远低于甲烷,从原子结构角度解释其原因:_____________________________________________________。
(3)下面是工业上冶炼Cr时涉及到的反应:
CrO42-+ S+ H2O→ Cr(OH)3↓+ S2O32-+
①请将方程式补充完整并配平____________________。
②上述反应中,若转移了3mol电子,得到的还原产物是__________mol。
③Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的电离方程式________。
(4)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。Ni(CO)4是________________晶体,Ni(CO)4易溶于下列_______(填序号)。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①KCl晶体②液态HCl③CO2 ④汞⑤CaCO3固体⑥稀硫酸⑦酒精C2H5OH ⑧熔融的NaCl ⑨浓氨水,其中属于电解质的是(填序号,下同)___________;属于非电解质的是____________;能导电的有__________。
(2)已知:2Fe3++2I===2Fe2++I2,2Fe2++Br2===2Fe3++2Br。在含有 FeI2和 FeBr2的溶液中通入少量 Cl2,则最先被氧化的离子是_____,I、Br、Fe2+还原性由强到弱的顺序为:___________。
(3)实验室里盛装NaOH溶液试剂瓶用橡皮塞或软木塞,而不用玻璃塞。用化学方程式解释:_________________________________________________
(4) 0.3mol氨气和0.4mol二氧化碳的质量之比___________,所含分子数之比______________,所含原子数之比____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g) + nB(g)![]() pC(g) H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
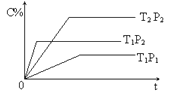
A. T1<T2 P1>P2 m+n<P Q<0B. T1>T2 P1<P2 m+n>P Q>0
C. T1<T2 P1<P2 m+n<P Q>0D. T1>T2 P1<P2 m+n>P Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中。KI还可用于分析试剂、感光材料、制药等,其制备原理如下:
反应I : 3I2+ 6KOH== KIO3 +5KI+ 3H2O
反应II: 3H2S+KIO3=3S↓+KI+ 3H2O
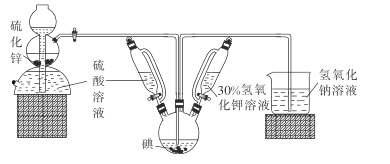
请回答有关问题。
(1)启普发生器中发生反应的化学方程式为_______。装置中盛装30%氢氧化钾溶液的仪器名称是_________。
(2)关闭启普发生器活塞,先滴入30%的KOH溶液.待观察到三颈烧瓶中溶液颜色由棕黄色变为______(填现象) ,停止滴人KOH溶液;然后______(填操作),待三颈烧瓶和烧杯中产生气泡的速率接近相等时停止通气。
(3)滴入硫酸溶液,并对三颈烧瓶中的溶液进行水浴加热,其目的是_____________。
(4)把三颈烧瓶中的溶液倒入烧杯中,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还含有硫酸钡和___________(填名称)。合并滤液和洗涤液,蒸发至析出结晶,干燥得成品。
(5)实验室模拟工业制备KIO3流程如下:
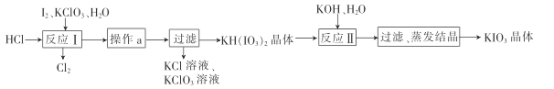
几种物质的溶解度见下表:
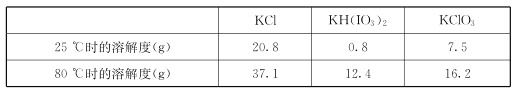
①由上表数据分析可知,“操作a”为__________________。
②用惰性电极电解KI溶液也能制备KIO3,与电解法相比,上述流程制备KIO3的缺点是____________。
(6)某同学测定.上述流程生产的KIO3样品的纯度。
取1.00 g样品溶于蒸馏水中并用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加2.0 mol●L-1 Na2S2O3 溶液,恰好完全反应时共消耗12. 60 mL Na2S2O3溶液。该样品中KIO3的质量分数为_______(已知反应:I2+2Na2S2O3=2NaI+Na2S4O6)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。

(装置分析)
(1)装置①中反应的离子方程式是____________________________。
(2)装置②中的试剂是________(填序号)。
a.饱和NaHCO3溶液 b.饱和Na2CO3溶液 c.浓H2SO4
(3)装置③中的试剂是__________。
(进行实验)
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是_____________。
(5)过氧化钠跟二氧化碳反应的化学方程式是______________________。
(实验反思)
(6)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是______。
(7)需要补充的实验操作是:取⑤中反应后的少量固体,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙、丙、丁四个烧杯中分别盛有100mL蒸馏水,然后分别放入等物质的量的Na、Na2O、Na2O2、NaOH,待固体完全溶解,则四个烧杯中溶液的质量分数的大小顺序为( )
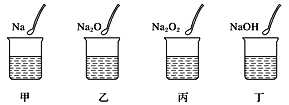
A.甲<乙<丙<丁B.丁<甲<乙=丙C.甲=丁<乙=丙D.丁<甲<乙<丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
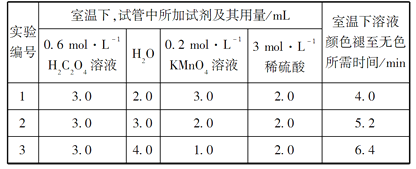
请回答:
(1)以上反应的化学方程式:__________________。
(2)根据上表中的实验数据,可以得到的结论是:_____________。
(3)利用实验1中数据计算,用KMnO4的浓度变化表示反应速率v(KMnO4)=_____。

(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①小组同学提出的假设是____________。
②请你帮助该小组同学完成实验方案_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com