
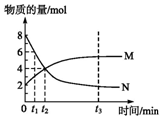
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )| A. | 化学方程式:2N?M | B. | t2时,正逆反应速率相等,达到平衡 | ||
| C. | t3时,正反应速率大于逆反应速率 | D. | t1时,M的浓度是N浓度的2倍 |
分析 在t2时,N的物质的量为4mol,变化4mol,M的物质的量为4mol,变化2mol,反应的方程式为2N?M,结合图象解答该题.
解答 解:A.在t2时,N的物质的量为4mol,变化4mol,M的物质的量为4mol,变化2mol,反应的方程式为2N?M,故A正确;
B.t2时,M、N物质的量还在变化,所以没有达到平衡状态,故B错误;
C.t3时,达到平衡状态,则正逆反应速率相等,故C错误;
D.t1时,N的物质的量为6mol,M的物质的量为3mol,则N的浓度是M浓度的2倍,故D错误;
故选A.
点评 本题考查化学平衡与图象问题的考查,侧重于学生的分析能力的考查,为高考常见题型,难度中等,注意把握图象曲线变化的趋势以及平衡状态的判断.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4+、SO32-、AlO2- | B. | NH4+、Br-、CO32- | ||
| C. | Fe2+、S2-、SO32- | D. | NH4+、Br-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2) | B. | (3)(4) | C. | (1)(2)(3)(4) | D. | (1)(3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①③⑤⑥ | C. | ①②③④⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
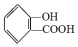 ,
,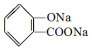 ;请写出将
;请写出将 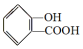 转化为
转化为 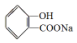 的化学方程式
的化学方程式 +NaHCO3→
+NaHCO3→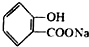 +H2O+CO2↑.
+H2O+CO2↑.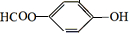
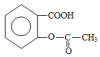 ,它与足量氢氧化钠溶液发生反应的方程式是
,它与足量氢氧化钠溶液发生反应的方程式是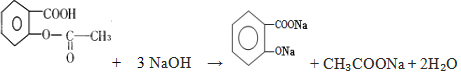 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁与水的反应实验:取一小段镁带,直接投入试管,向试管中加入2ml水并滴入2滴酚酞溶液,加热试管至沸腾,观察到溶液变红 | |
| B. | 为了确定酸碱中和是放热反应,实验中向10ml 2mol/L NaOH溶液中加入浓硫酸至恰好中和,测定出溶液温度升高 | |
| C. | 原电池能将化学能转化为电能:将锌片和铜片用导线连接(导线中间接入一个电流表),平行插入盛有稀硫酸溶液的烧杯中,观察到电流表指针偏转 | |
| D. | 探究不同催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLFeCl3溶液,向第二试管中加入2mL5%H2O2和少量MnO2粉末,不同的催化剂对化学反应速率的影响不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 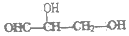 | B. | 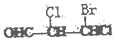 | C. | CH3CH2COOH | D. | 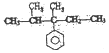 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
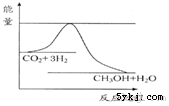 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com