

分析 废钒催化剂的主要成分V2O5、Fe2O3和SiO2等,据物质的水溶性确定,V2O5和SiO2难溶于水,即为得到的滤渣亚硫酸根具有还原性,酸性条件下,能被五氧化二钒氧化生成硫酸根离子,离子反应方程式为:V2O5+SO32-+4H+=2VO2++SO42-+2H2O,分析平衡,Rn+(水层)+nHA(有机层)?RAn(有机层)+nH+(水层),加入的碱会和平衡中的氢离子反应促进平衡正向进行;加入硫酸抑制平衡正向进行,氯酸钾具有氧化性,能将VO2+氧化为VO2+,加入氨水,调节溶液pH到最佳值,得到NH4VO3,最后焙烧得到五氧化二钒即可.
(1)根据影响化学反应速率的因素来回答;
(2)亚硫酸根具有还原性,酸性条件下,能被五氧化二钒氧化生成硫酸根离子,据此书写离子方程式;
(3)反萃取时加入的硫酸试剂是抑制平衡正向进行;
(4)金属铝和矾的氧化物反应得到金属钒和氧化铝,据此书写方程式;
(5)当左槽溶液逐渐由黄变蓝,即VO2+转化为VO2+,发生得电子的还原反应.
解答 解:(1)将固体粉碎,增加固体的表面积,可以加快浸出速率,
故答案为:增大固液接触面积,加快浸出速率,提高浸出率;
(2)亚硫酸根具有还原性,酸性条件下,能被五氧化二钒氧化生成硫酸根离子,离子反应方程式为:V2O5+SO32-+4H+=2VO2++SO42-+2H2O,
故答案为:V2O5+SO32-+4H+=2VO2++SO42-+2H2O;
(3)步骤③的操作名称为萃取分液,反萃取时分析平衡,VOSO4 +(水层)+2HA2(有机层)?VOA2(有机层)+H2SO4(水层),加入硫酸抑制平衡正向进行,使VOSO4进入水层;
故答案为:萃取、分液;加入硫酸使平衡向左移动,使VOSO4进入水层;
(4)金属铝热还原制得钒的原理是:金属铝和矾的氧化物反应得到金属钒和氧化铝,其化学方程式为:3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,
故答案为:3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(5)当左槽溶液逐渐由黄变蓝,即VO2+转化为VO2+,此时该极上发生得电子的还原反应,其电极反应式为VO2++2H++e-═VO2++H2O,
故答案为:VO2++2H++e-═VO2++H2O.
点评 本题考查了流程分析判断、物质性质和实验设计的方法应用、原电池原理分析、题干信息分析判断能力,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
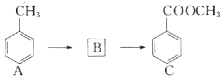 化合物C是某合成路线的中间体,可通过下列(如图)路径合成:
化合物C是某合成路线的中间体,可通过下列(如图)路径合成: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可以与酸性高锰酸钾溶液反应,因此可以用酸性高锰酸钾溶液除去乙烷中混有的乙烯 | |
| B. | 溴乙烷可以通过乙烯与溴化氢加成得到,也可以通过乙烷与溴发生取代反应制备 | |
| C. | 区分甲苯和苯可以使用酸性高锰酸钾溶液,也可以用溴的四氯化碳溶液 | |
| D. | 鉴别己烯中是否混有少量甲苯,正确的实验方法是可以加足量溴的四氯化碳溶液,然后再加入酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应前O2的体积为560 mL | B. | 化合物XY3的摩尔质量为86 g/mol | ||
| C. | XY3的质量为0.99g | D. | 反应后气体总质量约为1.79 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P4和CH4都是正四面体分子且键角都为109o28ˊ | |
| B. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | NO3-和CO32-是等电子体,均为平面正三角形结构 | |
| D. | 金属晶体与熔融态的离子晶体导电都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(mim) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(ML) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
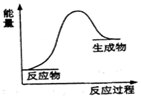
| A. | Ba(OH)2•8H2O与NH4Cl反应 | |
| B. | 铝与稀盐酸 | |
| C. | 灼热的炭与水蒸气生成一氧化碳和氢气的反应 | |
| D. | 煤与O2的燃烧反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com