
| A. | 将钠块投入到硫酸铜溶液中,可析出单质铜 | |
| B. | 将钠块长时间暴露在空气中的最终产物是Na2CO3 | |
| C. | Na2O与Na2O2阴阳离子个数比相同 | |
| D. | Na2O2能使品红溶液褪色且原理与SO2相同 |
分析 A、钠和盐溶液反应时,先和水反应,如果能发生复分解反应,则再发生复分解反应;
B、因钠与空气中氧气极易反应,致使钠表面变暗,氧化钠与空气中的水蒸气反应生成白色固体氢氧化钠,氢氧化钠易潮解表面变成溶液,氢氧化钠是强碱与空气中的酸性气体反应,生成白色带结晶水的固体Na2CO3.10H2O,十水碳酸钠易风化生成白色粉末碳酸钠;
C、Na20是由钠离子和氧离子构成的离子化合物,Na202是由钠离子和过氧根离子构成的离子化合物;
D、Na2O2能使品红溶液褪色是过氧化钠的强氧化性,而SO2生成无色不稳定的大分子.
解答 解:A、钠投入硫酸铜溶液时,钠和水反应生成氢氧化钠和氢气,氢氧化钠再和硫酸铜发生复分解反应生成氢氧化铜蓝色沉淀,所以得不到金属单质铜,故A错误;
B、因钠与空气中氧气极易反应,致使钠表面变暗,氧化钠与空气中的水蒸气反应生成白色固体氢氧化钠,氢氧化钠易潮解表面变成溶液,氢氧化钠是强碱与空气中的酸性气体反应,生成白色带结晶水的固体Na2CO3.10H2O,十水碳酸钠易风化生成白色粉末碳酸钠,故B正确;
C、Na20是由钠离子和氧离子构成的离子化合物,电子式为 ,所以阴阳离子个数比是1:2,Na202是由钠离子和过氧根离子构成的离子化合物,电子式为
,所以阴阳离子个数比是1:2,Na202是由钠离子和过氧根离子构成的离子化合物,电子式为 ,阴阳离子个数比是1:2,故C正确;
,阴阳离子个数比是1:2,故C正确;
D、Na2O2能使品红溶液褪色是过氧化钠的强氧化性,而SO2生成无色不稳定的大分子,所以两的褪色的原理不同,故D错误;
故选BC.
点评 本题主要考查了钠的性质与用途,注意知识的积累,学生要知道二氧化硫的漂白是生成无色不稳定的大分子,而过氧化钠具有强氧化性,难度不大.


科目:高中化学 来源: 题型:推断题

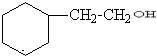 .
.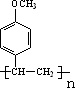 .
.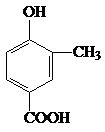 +CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
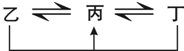 有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系:
有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系: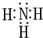 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | Cu | Fe | 盐酸 | 过滤 |
| B | AlCl3 | NaAlO2 | 盐酸 | - |
| C | FeCl2溶液 | FeCl3 | Fe | - |
| D | NaHCO3溶液 | Na2CO3 | CO2 | - |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若有0.2mol氧化剂反应,则转移电子的物质的量为1.0mol | |
| B. | 若氧化产物比还原产物多0.35mol,生成8.96LN2(标准状况) | |
| C. | 若氧化产物比还原产物多0.35mol,有0.050molKNO3被氧化 | |
| D. | KNO3的氧化性强于N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅用新制氢氧化铜悬浊液(可以加热)不能通过化学方法完成对葡萄糖溶液、乙醇和乙酸溶液的鉴别 | |
| B. | 利用加碳酸钠饱和溶液和分液的方法可以除去乙酸乙酯中的乙酸和乙醇 | |
| C. | CH3CH2CH2OH和CH3CH2CH2Cl的同分异构体数目相同 | |
| D. | 石油的分馏、裂化,煤的干馏,都是通过化学变化获得新物质的工业生产方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:1:3 | C. | 1:3:1 | D. | 3:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际单位制中的一种物理量 | B. | 摩尔是物质的量的单位 | ||
| C. | 摩尔简称摩,它的符号是mol | D. | 1 mol氧原子可表示为“1 mol O” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 只有①④ | C. | 只有①③④ | D. | 只有①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com