
| A. | C、N、O三种元素第一电离能从大到小的顺序是 O>N>C | |
| B. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| C. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| D. | Ni原子的核外电子排布式为1s22s22p63s23p63d84s2 |
分析 A、同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
B、同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素;
C、主族元素中,元素最高正化合价与其族序数相等,但O、F元素除外;
D、Ni是28号元素,其原子核外有28个电子.
解答 解:A、C、N、O元素处于同一周期,且原子序数依次增大,但N元素处于第VA族,所以第一电离能顺序为N>O>C,故A错误;
B、同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,所以Mg元素第一电离能大于Al元素,故B错误;
C、主族元素中,元素最高正化合价与其族序数相等,但O、F元素除外,所以卤族元素中除了F元素外其它元素最高正化合价为+7,故C错误;
D、Ni是28号元素,所以核外电子排布式为1s22s22p63s23p63d84s2,故D正确;
故选D.
点评 本题考查较综合,涉及第一电离能大小判断、元素化合价与族序数的关系等知识点,侧重考查学生对物质结构和元素周期律等基本理论的考查,易错选项是BC,要注意规律中的异常现象,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 自然界中有11H、12H、13H三种氢的同位素,它们的化学性质不相同 | |
| B. | ${\;}_{1}^{1}$H失去1个电子后,变成1个质子 | |
| C. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是三种不同的原子 | |
| D. | 11H、21H、31H在化学反应中容易失去一个电子而显+1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 等物质的量的氯气与乙烷在光照下反应(氯乙烷) | |
| C. | 乙烯与水加成(乙醇) | |
| D. | 乙烯与氯化氢在一定条件下反应(氯乙烯) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,工业合成路线如下:
,工业合成路线如下:

 (R-代表烃基)
(R-代表烃基) 、
、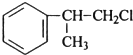 ;
;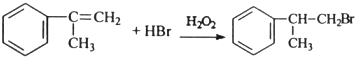 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ni2+:[Ar]3d8 | B. | Cu:[Ar]3d94s2 | C. | S2-:[Ne]2s23p6 | D. | Si:[Ar]3s23p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CO | H2 | CH3OH(g) | ||
| Ⅰ | T1 | 0.2 | 0.4 | 0.18 |
| Ⅱ | T1 | 0.4 | 0.8 | |
| Ⅲ | T2 | 0.2 | 0.4 | 0.16 |
| A. | 该反应的正反应为放热反应 | |
| B. | 达平衡时,容器Ⅰ中CH3OH(g)的体积分数比容器Ⅱ中的大 | |
| C. | 采取加压、增大c(H2)、加入合适的催化剂等措施,都能提高CO的转化率 | |
| D. | 若起始时向容器Ⅰ中充入CO 0.2 mol、H2 0.2 mol、CH3OH(g)0.5 mol,则反应将向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;C 单质在高温下与B单质充分反应所得化合物的电子式为
;C 单质在高温下与B单质充分反应所得化合物的电子式为
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com