
 原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答:
原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答:分析 (1)放电时,铅失电子,铅作负极,铅的化合价升高被氧化成二价铅离子,并与硫酸反应生成硫酸铅;工作时,电解质溶液中阴离子移向负极;根据转移电子的物质的量之间的关系式计算;
(2)①燃料电池中,通入燃料的电极是负极,负极上燃料氢气失电子发生氧化反应生成氢离子,氢离子与电解质溶液中的氢氧根反应生成水,通入氧化剂的电极是正极,正极上氧化剂氧气得电子发生还原反应;
②若电解液为H2SO4溶液,负极上氢气失电子生成氢离子,正极上氧气得电子和氢离子反应生成水;
③把氢气改为甲烷,以硫酸做电解质,负极上甲烷失电子生成二氧化碳和氢离子.
解答 解:(1)放电时,铅作负极,负极上铅失电子和硫酸反应生成硫酸铅,电极反应式为:Pb-2e-+SO42-=PbSO4;工作时,电解质溶液中阴离子移向负极;放电时,正极上PbO2得电子和H2SO4反应生成PbSO4,电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,关系式为:PbO2~2e-~PbSO4,当外电路通过2mol电子时,生成1molPbSO4,正极增重的质量可以看作1molSO2的质量,即64g,若外电路有0.2mol电子通过,正极质量理论上增加6.4g,
故答案为:铅;Pb-2e-+SO42-=PbSO4;负;6.4;
(2)①燃料电池中,通入燃料的电极是负极,通入氧化剂的电极是正极,所以通入氢气的电极是负极、通入氧气的电极是正极,负极上电极反应式为2H2+4OH--4e-=2H2O,正极上电极反应式为O2+2H2O+4e-=4OH-,
故答案为:2H2+4OH--4e-=2H2O;O2+2H2O+4e-=4OH-;
②若电解液为H2SO4溶液,负极上氢气失电子生成氢离子,正极上氧气得电子和氢离子反应生成水,所以负极电极反应式为2H2-4e-=4H+,正极电极反应式为O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O;
③若把H2改为CH4,以硫酸做电解质,负极上甲烷失电子生成二氧化碳和氢离子,电极反应式为CH4-8e-+2H2O=CO2+8H+,
故答案为:CH4-8e-+2H2O=CO2+8H+.
点评 本题考查了原电池原理,根据原电池正负极上得失电子确定发生的电极反应,难点是电极反应式的书写,书写时要结合电解质溶液酸碱性,燃料、氧化剂相同,但电解质溶液酸碱性不同,其电极反应式不同,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
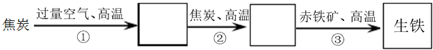
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成2mol H2的同时消耗了1mol CO | |
| B. | c(CO):c(CH3OH)=1:1 | |
| C. | 在恒温恒容的容器中,混合气体的压强保持不变 | |
| D. | 在绝热恒容的容器中,反应的平衡常数不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
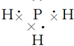 ,结构式
,结构式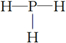 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
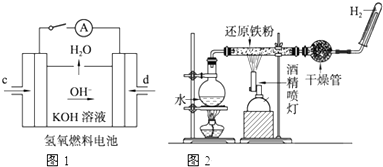
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
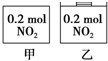 甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )| A. | 平衡时各容器内c(NO2)的大小顺序为乙>甲 | |
| B. | 平衡时N2O4的百分含量:乙>甲 | |
| C. | 平衡时甲中的压强与乙中的压强:甲>乙 | |
| D. | 平衡时混合物的平均相对分子质量:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| B. | 机动车实行限行措施是减少雾霾的途径之一 | |
| C. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com