
【题目】表是元素周期表的一部分,回答下列有关问题: 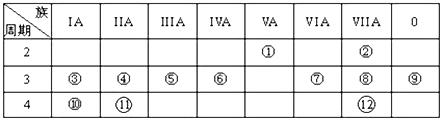
(1)画出⑥的原子结构示意图: , 写出①的气态氢化物分子的电子式 .
(2)元素④、⑩、的最高价氧化物水化物的碱性最强的为;元素②、⑦、⑧的氢化物稳定性由强到弱的顺序为(均用化学式填空).
(3)③与氧形成的化合物R2O2中所含化学键类型为 .
(4)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,有一新型燃料电池,是用两根金属做电极插入KOH溶液中,然后向X极通入A的最简单气态氢化物,向Y极通入O2 , 请写出电极反应式: 负极正极 .
【答案】
(1)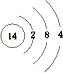 ;
;![]()
(2)KOH;HF>HCl>H2S
(3)离子键、共价键
(4)CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O;O2+2H2O+4e﹣=4OH﹣
【解析】解:由元素在周期表的位置可知,从①开始元素分别为N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br,(1)⑥为Si,原子序数为14,原子结构式为 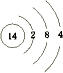 ;①的气态氢化物为氨气,其电子式为
;①的气态氢化物为氨气,其电子式为 ![]() ,所以答案是:
,所以答案是:  ;
; ![]() ;(2)金属性越强,最高价氧化物水化物的碱性越强;非金属性越强,最高价氧化物水化物的酸性越强,则元素④、⑩、的最高价氧化物水化物的碱性最强的为KOH;元素②、⑦、⑧的氢化物稳定性由强到弱的顺序为HF>HCl>H2S,所以答案是:KOH;HF>HCl>H2S;(3)③与氧形成的化合物Na2O2 , 含离子键和共价键,所以答案是:离子键、共价键;(4)与①和⑥都相邻的一种元素A为C,A的最简单气态氢化物为甲烷,向Y极通入O2 , 可知甲烷在负极失去电子,氧气在正极得到电子,则负极反应为CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O,正极反应为O2+2H2O+4e﹣=4OH﹣ , 所以答案是:CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O;O2+2H2O+4e﹣=4OH﹣ .
;(2)金属性越强,最高价氧化物水化物的碱性越强;非金属性越强,最高价氧化物水化物的酸性越强,则元素④、⑩、的最高价氧化物水化物的碱性最强的为KOH;元素②、⑦、⑧的氢化物稳定性由强到弱的顺序为HF>HCl>H2S,所以答案是:KOH;HF>HCl>H2S;(3)③与氧形成的化合物Na2O2 , 含离子键和共价键,所以答案是:离子键、共价键;(4)与①和⑥都相邻的一种元素A为C,A的最简单气态氢化物为甲烷,向Y极通入O2 , 可知甲烷在负极失去电子,氧气在正极得到电子,则负极反应为CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O,正极反应为O2+2H2O+4e﹣=4OH﹣ , 所以答案是:CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O;O2+2H2O+4e﹣=4OH﹣ .


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的工业制法中,错误的是( )
A. 制钠:以海水为原料制得NaCl,再电解熔融NaCl得钠
B. 制铁:以焦炭和铁矿石为原料,用CO还原铁矿石得铁
C. 制硅:用焦炭还原二氧化硅得硅
D. 制铝:电解液态氯化铝得铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、铁的化合物有广泛的应用。
(1)过二硫酸铵(NH4)2S2O8可以看成双氧水的衍生物,H2O2分子中的两个H原子被—SO3H基取代后即为过二硫酸。
①(NH4)2S2O8中硫元素的化合价为_________;
②用过二硫酸铵溶液检测废水中的Mn2+,配平下面的离子反应:
__S2O82-+__Mn2++__=___MnO4-+__SO42-+____。
(2)大苏打的成分是Na2S2O3·5H2O,常用于防毒面具中吸收氯气。若1 mol Na2S2O3完全反应,失去8mol电子。写出其水溶液吸收氯气的离子方程式______________。
(3)磁性材料A是由两种元素组成的化合物,某研究小组按如图所示流程探究其组成:

①A的化学式为____________;
②已知化合物A能与盐酸反应,生成一种淡黄色不溶物和一种气体(标准状况下密度为1.518g/L),写出该反应的离子方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,在一定条件下既能发生加成反应,又能发生取代反应,但不能使酸性KMnO4溶液褪色的是( )
A. 甲烷 B. 苯
C. 乙烯 D. 乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些夹持装置省略)所示。已知SO2Cl2的熔点为- 54.1℃,沸点为69.1℃,在潮湿空气中遇水能发生剧烈的水解反应,并产生白雾。

(1)仪器组装完毕后,检验戊装置气密性的方法是___________________,表明装置气密性良好。
(2)仪器C的作用是吸收逸出的有毒气体Cl2、SO2,防止污染环境和__________________。
(3)试剂X、Y的组合最好是__________________(填字母)。
a.18.4 mol/L H2SO4+Cu b.4 mol/L HNO3 +Na2SO3 c.60% H2SO4+K2SO3
(4)戊是贮气装置,则E中的试剂是______;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是:________________。
(5)反应结束后,将丙中的混合物分离开的实验操作是______。若反应中消耗的氯气的体积为896 ml。(已转化为标准状况,SO2足量),最后得到纯净的磺酰氯3.3 g,则磺酰氯的产率为 ______(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或化学方程式,正确的是
A. 氯气通入水中:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向 Fe(NO3)2 稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
C. 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++H2O
D. 向石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的叙述正确的是
A.锌锰干电池中,锌电极是负极
B.手机用的锂离子电池属于一次电池
C.氢氧燃料电池工作时氢气在负极被还原
D.太阳能电池的主要材料为二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCI)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从某酸性废液(主要含Cu2+、Fe3+、H+、Cl-中制备氯化亚铜。

请回答下列问题:
(1)出步驟①中发生的两个主要反应的离子方程式:________________________。
(2)步骤②的操作名称是___________。
(3)步骤④中所加物质X为___________。
(4)步骤⑤的操作是___________。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是___________。
(6)在CuCl的生成过程中,可以循环利用的物质是______,理论上______ (填“是”或“否”)需要补充(不考虑调节等消耗):理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式己配平): Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成,则A应该属于______(填序号)
a.电解质 b.非电解质 c.硫化物 d.酸性氧化物 e.碱性氧化物
(2)A物质可以使酸性KMnO4溶液褪色,此反应中______(填写化学式,下同)失去电子,还原产物是______。
(3)一定量的铜片与100mL18mol/L的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的质量为______g,发生还原反应的硫酸的物质的量为___________mol。
(4)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应。请写出此过程发生的反应的离子方程式:______、_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com