
| A. | 向某溶液中,先加入氯水后滴入KSCN溶液,若溶液呈红色,则说明溶液中含有Fe2+ | |
| B. | 用铂丝蘸取待测液放在火焰上灼烧,若火焰呈黄色,则说明待测液中含有钠离子,不含钾离子 | |
| C. | 分液时,分液漏斗中下层液体从下口放出后,将上层液体从上口倒入另一个洁净的烧杯中 | |
| D. | 蒸馏时,应将温度计的水银球插入蒸馏烧瓶内的混合液体中 |
分析 A.溶液中可能含有Fe3+;
B.K元素的焰色反应必须透过蓝色钴玻璃观察;
C.分液时要防止液体重新混合而污染;
D.蒸馏时,测定的是蒸汽的温度.
解答 解:A.向某溶液中,先加入氯水后滴入KSCN溶液,若溶液呈红色,则说明溶液中含有Fe3+,原溶液中可能含有Fe2+,故A错误;
B.K元素的焰色反应必须透过蓝色钴玻璃观察,滤去黄光的干扰,焰色反应为黄色,则说明待测液中含有钠离子,不能确定是否含钾离子,故B错误;
C.分液时要防止液体重新混合而污染,应为下层液体从下口放出后,换个洁净的烧杯,将上层液体从上口放入烧杯中,故C正确;
D.蒸馏时,测定的是蒸汽的温度,因此温度计的水银球插入蒸馏烧瓶的支管口处,故D错误.
故选C.
点评 本题考查物质的鉴别、物质的分离、提纯等基本实验操作,侧重于学生的分析能力和实验能力的考查,难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 熵变大于0的反应肯定是自发的 | |
| B. | 焓变小于0的反应肯定是自发的 | |
| C. | 对于同一物质在不同状态时的熵值是:气态>液态>固态 | |
| D. | 自发反应的反应速率肯定很快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )| A. | 1.0 mol/L,20 mL | B. | 0.5 mol/L,40 mL | C. | 0.5 mol/L,80 mL | D. | 1.0 mol/L,80 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.实验室常用的盐酸是密度1.20g•cm-3、质量分数36.5%.
Ⅰ.实验室常用的盐酸是密度1.20g•cm-3、质量分数36.5%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
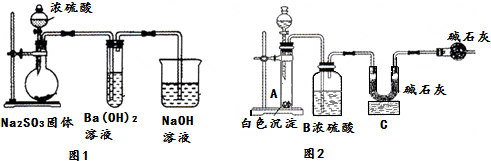
| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量稀盐酸,充分振荡. | 若沉淀部分溶解,则含有②. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com