
| A. | ①②④ | B. | ②⑤⑧ | C. | ③⑧⑥ | D. | ⑥⑦ |
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-═CuS↓+H2S↑ | |
| B. | 向NH4Al(SO4)2溶液加入含两倍物质的量的Ba(OH)2溶液:Al3++2SO${\;}_{4}^{2-}$+4OH-+2Ba2+═2BaSO4↓+AlO${\;}_{2}^{-}$+2H2O | |
| C. | 向Na2S2O3溶液中通入足量的Cl2:S2O${\;}_{3}^{2-}$+2Cl2+3H2O═2SO${\;}_{3}^{2-}$+4Cl-+6H+ | |
| D. | 用石墨电极电解MgCl2溶液阴极电极反应:2H2O+2e-═H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y4X10分子中,极性键和非极性键的个数比为10:4 | |
| B. | Z和W形成的多种化合物中只有一种能与水反应 | |
| C. | 25℃时,Z、W、X按原子个数比2:3:4形成的化合物的水溶液的pH=7 | |
| D. | 25℃时,等浓度的Z和Q的最高价氧化物对应水化物的水溶液中,水电离的c(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
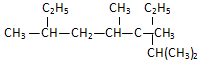 名称2,3,4,6-四甲基-3-乙基辛烷.
名称2,3,4,6-四甲基-3-乙基辛烷.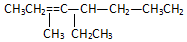 名称:2-甲基-3-乙基-1-戊烯.
名称:2-甲基-3-乙基-1-戊烯.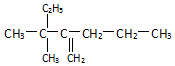 名称:3,3-二甲基-2-丙基-1-戊烯.
名称:3,3-二甲基-2-丙基-1-戊烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
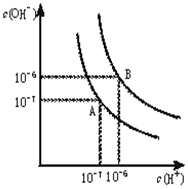 水的电离平衡曲线如下图所示.
水的电离平衡曲线如下图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题:
下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题: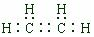 .
. ,A是一种常用的还原剂.向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式4AgBr+N2H4=4Ag+N2↑+4HBr.b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为1:2.
,A是一种常用的还原剂.向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式4AgBr+N2H4=4Ag+N2↑+4HBr.b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1的AlC13溶液中含有Al3+的数目小于2NA | |
| B. | 用石灰乳完全吸收1 molCl2时,转移的电子数为2 NA | |
| C. | 标准状况下,1 mol CH3Cl中含有的共价键数目为4 NA | |
| D. | 标准状况下,分子数均为NA 的O2与NO混合后,气体的体积约为44.8 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com