
【题目】已知在实验室浓盐酸和二氧化锰加热条件下可以反应生成氯化锰和Cl2等,某同学用此法制得标准状况下Cl2体积为22.4mL,据题意回答下列问题:
(1)写出其化学反应方程式并配平____________
(2)请计算共消耗MnO2多少克?_____________
(3)上述实验所用浓盐酸,其质量分数为36.5%,密度为1.19g/mL,为了使用方便,请计算该浓盐酸的物质的量浓度为多少?_______________
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:常温下,Ksp(Ag2X)=1.4×10-5,Ksp(Ag2Y)=8.1×10-12,Ksp(AgZ)=1.8×10-10,Ksp(AgR)=8.3×10-17。在下列各饱和溶液中,c(Ag+)由小到大的排序是( )
A.AgR<Ag2Y<Ag2X<AgZB.AgR<AgZ<Ag2Y<Ag2X
C.AgZ<AgR<Ag2X<Ag2YD.AgR<Ag2Y<AgZ<Ag2X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是1molCO(g)和2molH2(g)发生反应CO(g)+2H2(g)→CH3OH(g)过程中的能量变化曲线。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂时反应的能量变化。下列相关说法正确的是( )

A.使用催化剂后该反应从放热反应变成了吸热反应
B.使用和不使用催化剂相比反应的能量变化不同
C.1molCO(g)和2molH2(g)中的化学键完全被破坏需要吸收510kJ能量
D.1molCO(g)和2molH2(g)完全反应生成1molCH3OH(g)会释放出91kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10L含有丙烯,丁炔和甲烷的混合物与足量O2混合点燃后,恢复到原来状态(常温、常压),气体体积共缩小21L ,则甲烷的体积分数为
A. 20% B. 30% C. 80% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造。以镍粉废料为原料制备Ni2O3的工艺如下:
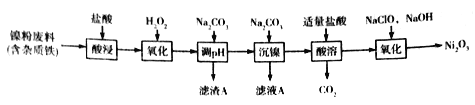
回答下列问题:
(1)Ni2O3中Ni的化合价为_________。
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是__________。
(3)加入H2O2“氧化”的离子方程式为_____________;滤渣A的主要成分是________(填化学式)。
(4)工艺中分步加入Na2CO3的作用是________;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为_________。
(5)工业上,用镍为阳极,电解0.1mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电流效率是指电解时,在电极上实际沉积的物质的量与理论析出量之比)及镍的成粉率的影响如图所示:
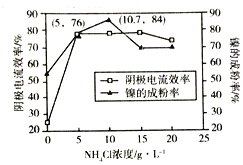
①为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为______mol/L.
②当NH4Cl溶液的浓度大于15g/L时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 常温下,在0.1mol·L-1的HNO3溶液中,由水电离出的c(H+)<![]()
B. 浓度为0.1mol·L-1的NaHCO3溶液:c(H2CO3)>c(CO32-)
C. 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
D. 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、 NH4+、H+、 N2、Cl-六种微粒。其中ClO-的物质的量随时间变化的曲线如图所示。下列判断正确的是( )

A. 该反应的还原剂是Cl- B. 反应后溶液的酸性明显增强
C. 消耗1mol还原剂,转移6 mol电子 D. 氧化剂与还原剂的物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaFeO4是一种高效多功能水处理剂。制备方法之一如下:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。下列说法正确的是
A. 氧化产物是Na2FeO4
B. 1molFeSO4还原3mol Na2O2
C. 转移0.5mo1电子时生成16.6g Na2FeO4
D. 氧化产物与还原产物的物质的量之比为3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com