
 Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖ100LµÄ¶ØČŻĆܱÕČŻĘ÷ÖŠ½ųŠŠÄ³»Æѧ·“Ó¦£¬·“Ó¦ĢåĻµÖŠø÷×é·ÖµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£ŗ
Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖ100LµÄ¶ØČŻĆܱÕČŻĘ÷ÖŠ½ųŠŠÄ³»Æѧ·“Ó¦£¬·“Ó¦ĢåĻµÖŠø÷×é·ÖµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£ŗ| ”÷c |
| ”÷t |
| m |
| n |
 M£¬¹Ź“š°øĪŖ£ŗ2N
M£¬¹Ź“š°øĪŖ£ŗ2N  M£»
M£»| n |
| V |
| 8mol-6mol |
| 100L |
| ”÷c(N) |
| t |
| 0.02mol/L |
| 1min |
| n |
| V |
| 4mol-2mol |
| 100L |
| ”÷c(N) |
| t |
| 0.02mol/L |
| 4min |
| M(Ē°) |
| M(ŗó) |
| n(ŗó) |
| n(Ē°) |
| 2+5 |
| 2+8 |
| 7 |
| 10 |
| 7 |
| 10 |



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖ1LµÄĆܱÕČŻĘ÷ÄŚ·ÅČė2mol N2O4ŗĶ8mol NO2£¬·¢ÉśČēĻĀ·“Ó¦£ŗ2NO2£Øŗģ×ŲÉ«£©?N2O4£ØĪŽÉ«£©£Ø”÷H£¼0£©£¬·“Ó¦ÖŠNO2”¢N2O4µÄĪļÖŹµÄĮæĖę·“Ó¦Ź±¼ä±ä»ÆµÄĒśĻßČēĶ¼£¬°“ĻĀĮŠŅŖĒó×÷“š£ŗ
Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖ1LµÄĆܱÕČŻĘ÷ÄŚ·ÅČė2mol N2O4ŗĶ8mol NO2£¬·¢ÉśČēĻĀ·“Ó¦£ŗ2NO2£Øŗģ×ŲÉ«£©?N2O4£ØĪŽÉ«£©£Ø”÷H£¼0£©£¬·“Ó¦ÖŠNO2”¢N2O4µÄĪļÖŹµÄĮæĖę·“Ó¦Ź±¼ä±ä»ÆµÄĒśĻßČēĶ¼£¬°“ĻĀĮŠŅŖĒó×÷“š£ŗ| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
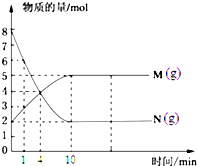
 Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖV LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦£¬M”¢NĮ½ÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£ŗ
Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖV LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦£¬M”¢NĮ½ÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£ŗ M
M M
M| 1 |
| (t2-t1)”Į v |
| 1 |
| (t2-t1)”Į v |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ£¬“ęŌŚČēĻĀ¹ŲĻµ£ŗxH2O£Øg£©?£ØH2O£©x£Øg£©£¬·“Ó¦ĪļŗĶÉś³ÉĪļµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»Æ¹ŲĻµČēĶ¼£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ£¬“ęŌŚČēĻĀ¹ŲĻµ£ŗxH2O£Øg£©?£ØH2O£©x£Øg£©£¬·“Ó¦ĪļŗĶÉś³ÉĪļµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»Æ¹ŲĻµČēĶ¼£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A”¢x=3 | ||
| B”¢øĆĪĀ¶ČĻĀ£¬·“Ó¦µÄĘ½ŗā³£ŹżĪŖ0.125L3/mol3 | ||
| C”¢Ę½ŗāŹ±»ģŗĻĘųĢåµÄĘ½¾łÄ¦¶ūÖŹĮæŹĒ33.3g/mol | ||
D”¢t1Ź±æĢ£¬±£³ÖĪĀ¶Č²»±ä£¬ŌŁ³äČė1mol H2O£Øg£©£¬ÖŲŠĀ“ļµ½Ę½ŗāŹ±£¬
|
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| AӢ16.7% | BӢ50% | CӢ66.7% | DӢ83.3% |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com