
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
 ;
;分析 短周期元素中,T元素原子最外层电子数是次外层电子数的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故T为O元素;常温下X单质为双原子分子,分子中含有3对共用电子对,则X为N元素;Y元素原子的M层比K层少1个电子,则Y为Na;Z是第3周期元素的简单离子中半径最小,则Z为Al.
解答 解:短周期元素中,T元素原子最外层电子数是次外层电子数的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故T为O元素;常温下X单质为双原子分子,分子中含有3对共用电子对,则X为N元素;Y元素原子的M层比K层少1个电子,则Y为Na;Z是第3周期元素的简单离子中半径最小,则Z为Al.
(1)T为O元素,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)同周期自左而右金属性减弱,故金属性Na>Al,
a.单质的熔点属于物理性质,不能比较金属性强弱,故a错误;
b.金属性强弱与化合价无关,与失去电子难易程度有关,故b错误;
c.金属性单质与水反应越剧烈,说明金属性越强,故c正确;
d.金属性越强,最高价氧化物的水化物的碱性越强,故d正确,
故答案为:Na;cd;
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物为Na2O2,该化合物与水反应的化学方程式:2Na2O2+2H2O═4NaOH+O2↑,
故答案为:Na2O2;2Na2O2+2H2O═4NaOH+O2↑;
(4)元素T和氢元素形成的化合物为水、过氧化氢,属于共价化合物,元素Z与元素T形成的化合物为氧化铝,属于离子化合物,
故答案为:共价化合物;离子化合物.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意金属性、非金属性强弱比较实验事实,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 等于90% | B. | 大于90% | C. | 小于90% | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
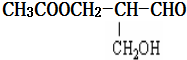
| A. | 与甲酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 在铜作催化剂与氧气加热反应 | D. | 在催化剂存在下与氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn是正极,Ag2O是负极 | |
| B. | 工作时电子由Zn极经溶液移向Ag2O极 | |
| C. | 该电池可将化学能100%转化为电能 | |
| D. | Zn是负极,反应为Zn-2 e-+2OH-=Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应活化能小于100 kJ•mol-1 | |
| B. | 逆反应活化能一定小于100 kJ•mol-1 | |
| C. | 正反应活化能不小于100 kJ•mol-1 | |
| D. | 正反应活化能比逆反应活化能小100 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量固体KHSO4,c(H+)增大,KW不变 | |
| B. | 向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量NH4Cl固体,平衡正向移动,c(H+)降低 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 剩余固体的组成 | m的取值范围 | n的取值范围 |
| 只有铜 | ||
| 有铁和铜 | (用含m的代数式表示) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com