
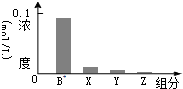
 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是 ( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是 ( )| A. | HA为强酸 | B. | 该混合溶液中:c(A-)+c(Y)=c(Na+) | ||
| C. | 图中X表示HA,Y表示H+,Z表示OH- | D. | 该混合液pH=7 |
分析 一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2O?HA+OH-,NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒为:c(Na+)=c(A-)+c(HA),据此分析.
解答 解:一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2O?HA+OH-,NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒得到:c(Na+)=c(A-)+c(HA).
A.一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,二者恰好反应:HA+NaOH=NaA+H2O,所得溶液为NaA溶液,溶液中中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2O?HA+OH-,NaA水解,HA为弱酸,故A错误;
B.X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒c(Na+)=c(A-)+c(HA),故B正确;
C.由分析可知,X表示OH-,Y表示HA,Z表示H+,故C错误;
D.c(Na+)>c(A-),说明NaA水解,A-+H2O?HA+OH-,该混合液pH>7,故D错误;
故选B.
点评 本题考查了酸碱混合溶液定性判断,根据酸的强弱结合物料守恒、电荷守恒分析解答,考查离子浓度大小比较、溶液PH值、盐类水解等,判断一元酸HA是弱酸为解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
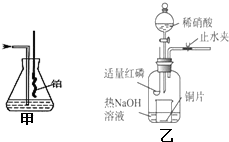 Ⅰ、实验室模拟氨催化氧化的装置如图甲:
Ⅰ、实验室模拟氨催化氧化的装置如图甲:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液 | B. | NaCl溶液 | C. | H2SO4溶液 | D. | K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质所含元素化合价升高的反应是氧化反应 | |
| B. | 物质所含元素化合价降低的反应是还原反应 | |
| C. | 氧化剂本身被还原,具有氧化性;还原剂本身被氧化,具有还原性 | |
| D. | 氧化反应和还原反应不一定同时存在于一个反应中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
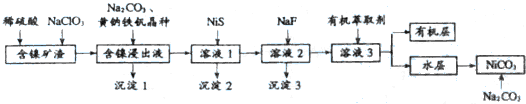
| 元素 | Na2+ | Fe3+ | Cu2+ | Ca2+ | Mg2+ | Zn2- |
| 浓度/g•L-1 | 5.25 | 0.47 | 0.30 | 0.40 | 0.18 | 0.81 |
| 开始沉淀PH | 6.4 | 2.2 | 4.7 | / | 9.6 | 6.5 |
| 完全沉淀PH | 8.4 | 3.5 | 6.7 | / | 11.6 | 8.5 |
| 难溶物 | NiS | CuS | ZnS | |
| 溶度积常数 | 1.07×10-21 | 1.27×10-26 | 2.93×10-25 | |
| 难溶物 | CaF2 | MgF2 | ZnF2 | NiF2 |
| 溶度积常数 | 1.46×10-10 | 7.42×10-11 | 3.04×10-2 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
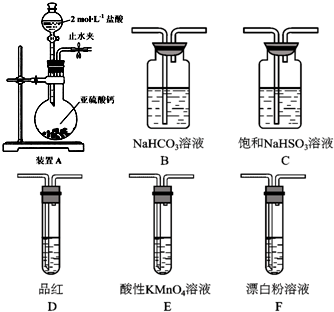
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
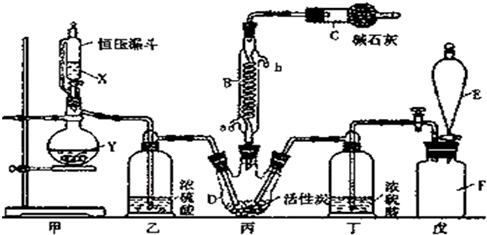
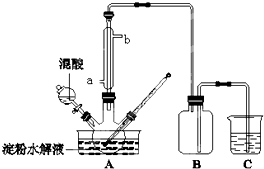 淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com